|
||||
|
|
13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей 13.1. Растворимость веществ в воде Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Водные растворы состоят из воды (растворителя) и растворенного вещества. Состояние веществ в водном растворе при необходимости обозначается нижним индексом (р), например, KNO3 в растворе – KNO3(p). Растворы, которые содержат малое количество растворенного вещества, часто называют разбавленными, а растворы с высоким содержанием растворенного вещества – концентрированными. Раствор, в котором возможно дальнейшее растворение вещества, называется ненасыщенным, а раствор, в котором вещество перестает растворяться при данных условиях, – насыщенным. Последний раствор всегда находится в контакте (в гетерогенном равновесии) с нерастворившимся веществом (один кристалл или более). В особых условиях, например при осторожном (без перемешивания) охлаждении горячего ненасыщенного раствора твердого вещества, может образоваться пересыщенный раствор. При введении кристалла вещества такой раствор разделяется на насыщенный раствор и осадок вещества. В соответствии с химической теорией растворов Д. И. Менделеева растворение вещества в воде сопровождается, во-первых, разрушением химических связей между молекулами (межмолекулярные связи в ковалентных веществах) или между ионами (в ионных веществах), и, таким образом, частицы вещества смешиваются с водой (в которой также разрушается часть водородных связей между молекулами). Разрыв химических связей совершается за счет тепловой энергии движения молекул воды, при этом происходит затрата энергии в форме теплоты. Во-вторых, попав в воду, частицы (молекулы или ионы) вещества подвергаются гидратации. В результате образуются гидраты – соединения неопределенного состава между частицами вещества и молекулами воды (внутренний состав самих частиц вещества при растворении не изменяется). Такой процесс сопровождается выделением энергии в форме теплоты за счет образования новых химических связей в гидратах. В целом раствор либо охлаждается (если затрата теплоты превосходит ее выделение), либо нагревается (в противном случае); иногда – при равенстве затраты теплоты и ее выделения – температура раствора остается неизменной. Многие гидраты оказываются настолько устойчивыми, что не разрушаются и при полном выпаривании раствора. Так, известны твердые кристаллогидраты солей CuSO4 5Н2O, Na2CO3 • 10Н2O, KAl(SO4)2 • 12Н2O и др. Содержание вещества в насыщенном растворе при Т = const количественно характеризует растворимость этого вещества. Обычно растворимость выражается массой растворенного вещества, приходящейся на 100 г воды, например 65,2 г КBr/100 г Н2O при 20 °C. Следовательно, если 70 г твердого бромида калия ввести в 100 г воды при 20 °C, то 65,2 г соли перейдет в раствор (который будет насыщенным), а 4,8 г твердого КBr (избыток) останется на дне стакана. Следует запомнить, что содержание растворенного вещества в насыщенном растворе равно, в ненасыщенном растворе меньше и в пересыщенном растворе больше его растворимости при данной температуре. Так, раствор, приготовленный при 20 °C из 100 г воды и сульфата натрия Na2SO4 (растворимость 19,2 г/100 г Н2O), при содержании 15,7 г соли – ненасыщенный; 19.2 г соли – насыщенный; 2O.3 г соли – пересыщенный. Растворимость твердых веществ (табл. 14) обычно увеличивается с ростом температуры (КBr, NaCl), и лишь для некоторых веществ (CaSO4, Li2CO3) наблюдается обратное. Растворимость газов при повышении температуры падает, а при повышении давления растет; например, при давлении 1 атм растворимость аммиака составляет 52,6 (20 °C) и 15,4 г/100 г Н2O (80 °C), а при 20 °C и 9 атм она равна 93,5 г/100 г Н2O.  В соответствии со значениями растворимости различают вещества: – хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (например, КBr – при 20 °C растворимость 65,2 г/100 г Н2O; 4,6М раствор), они образуют насыщенные растворы с молярностью более чем 0,1М; – малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (например, CaSO4 – при 20 °C растворимость 0,206 г/100 г Н2O; 0,015М раствор), они образуют насыщенные растворы с молярностью 0,1–0,001М; – практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя (например, AgCl – при 20 °C растворимость 0,00019 г на 100 г Н2O; 0,0000134М раствор), они образуют насыщенные растворы с молярностью менее чем 0,001М. По справочным данным составлена таблица растворимости распространенных кислот, оснований и солей (табл. 15), в которой указан тип растворимости, отмечены вещества, не известные науке (не полученные) или полностью разлагающиеся водой. Условные обозначения, используемые в таблице: «р» – хорошо растворимое вещество «м» – малорастворимое вещество «н» – практически нерастворимое вещество «—» – вещество не получено (не существует) « 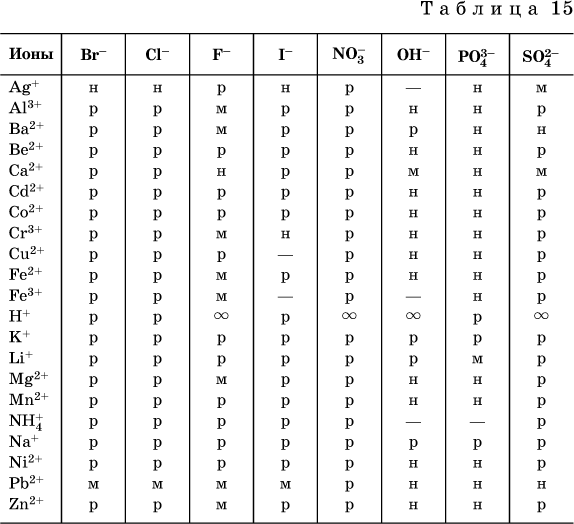 Примечание. Данная таблица отвечает приготовлению насыщенного раствора при комнатной температуре путем внесения вещества (в соответствующем агрегатном состоянии) в воду. Следует учесть, что получение осадков малорастворимых веществ с помощью реакций ионного обмена возможно не всегда (подробнее см. 13.4). 13.2. Электролитическая диссоциация Растворение любого вещества в воде сопровождается образованием гидратов. Если при этом в растворе не происходит формульных изменений у частиц растворенного вещества, то такие вещества относят к неэлектролитам. Ими являются, например, газ азот N2, жидкость хлороформ СНCl3, твердое вещество сахароза C12Н22О11, которые в водном растворе существуют в виде гидратов их молекул. Известно много веществ (в общем виде МА), которые после растворения в воде и образования гидратов молекул MA nН2O претерпевают существенные формульные изменения. В результате в растворе появляются гидратированные ионы – катионы М+ • nН2O и анионы А • nН2O: 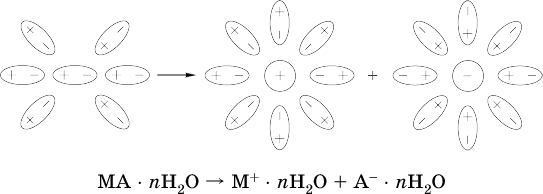 Такие вещества относят к электролитам. Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887). Электролитическая диссоциация ионных кристаллических веществ (М+)(А-) в воде является необратимой реакцией: 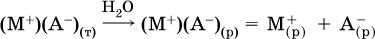 Такие вещества относятся к сильным электролитам, ими являются многие основания и соли, например:  Электролитическая диссоциация веществ MA, состоящих из полярных ковалентных молекул, является обратимой реакцией: 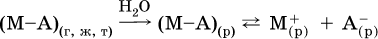 Такие вещества относят к слабым электролитам, ими являются многие кислоты и некоторые основания, например: а) 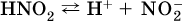 б) 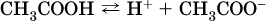 в) 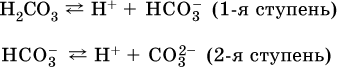 г) 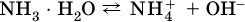 В разбавленных водных растворах слабых электролитов мы всегда обнаружим как исходные молекулы, так и продукты их диссоциации – гидратированные ионы. Количественная характеристика диссоциации электролитов называется степенью диссоциации и обозначается ?[1], всегда ? > 0. Для сильных электролитов ? = 1 по определению (диссоциация таких электролитов полная). Для слабых электролитов степень диссоциации – отношение молярной концентрации продиссоциировавшего вещества (сд) к общей концентрации вещества в растворе (с): 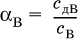 Степень диссоциации – это доля от единицы или от 100 %. Для слабых электролитов ? « С 1 (100 %). Для слабых кислот НnА степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей: 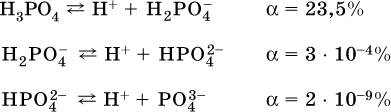 Степень диссоциации зависит от природы и концентрации электролита, а также от температуры раствора; она растет при уменьшении концентрации вещества в растворе (т. е. при разбавлении раствора) и при нагревании. В разбавленных растворах сильных кислот НnА их гидроанионы Нn-1А не существуют, например: 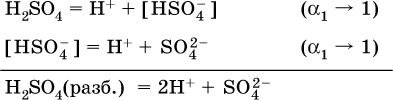 B концентрированных растворах содержание гидроанионов (и даже исходных молекул) становится заметным: 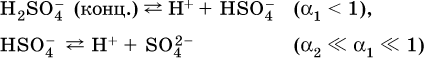 (суммировать уравнения стадий обратимой диссоциации нельзя!). При нагревании значения ?1 и ?2 возрастают, что способствует протеканию реакций с участием концентрированных кислот. Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют: 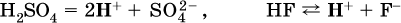 Распространенные сильные кислоты:  В разбавленном водном растворе (условно до 10 %-ного или 0,1-молярного) эти кислоты диссоциируют полностью. Для сильных кислот НnА в список вошли их гидроанионы (анионы кислых солей), также диссоциирующие полностью в этих условиях. Распространенные слабые кислоты: 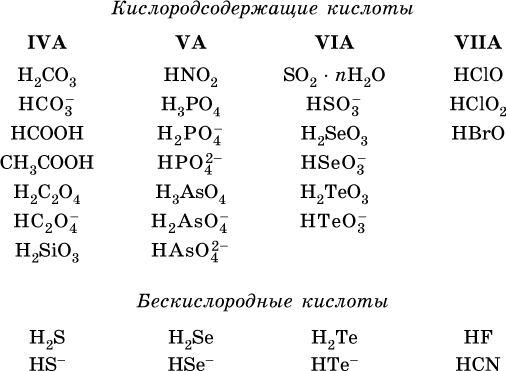 Основания – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют: 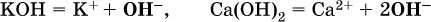 Диссоциация малорастворимых оснований Mg(OH)2, Cu(OH)2, Mn(OH)2, Fe(OH)2 и других практического значения не имеет. К сильным основаниям (щелочам) относятся NaOH, КОН, Ва(ОН)2 и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH3 Н2O. Средние соли – это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н+, и любые анионы, кроме ОН-: 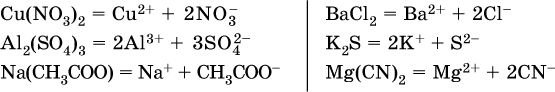 Речь идет только о хорошо растворимых солях. Диссоциация малорастворимых и практически нерастворимых солей значения не имеет. Аналогично диссоциируют двойные соли: 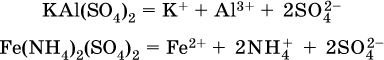 Кислые соли (большинство из них растворимы в воде) диссоциируют полностью по типу средних солей:  Образующиеся гидроанионы подвергаются, в свою очередь, воздействию воды: а) если гидроанион принадлежит сильной кислоте, то он сам диссоциирует также полностью: 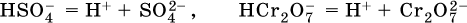 и полное уравнение диссоциации запишется в виде: 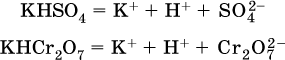 (растворы таких солей обязательно будут кислыми, как и растворы соответствующих кислот); б) если гидроанион принадлежит слабой кислоте, то его поведение в воде двойственно – либо неполная диссоциация по типу слабой кислоты: 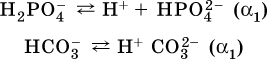 либо взаимодействие с водой (называемое обратимым гидролизом): 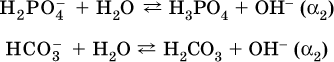 При ?1 > ?2 преобладает диссоциация (и раствор соли будет кислым), а при ?1 > ?2 – гидролиз (и раствор соли будет щелочным). Так, кислыми будут растворы солей с анионами HSO3-, H2PO4-, H2AsO4- и HSeO3-, растворы солей с другими анионами (их большинство) будут щелочными. Другими словами, название «кислые» для солей с большинством гидроанионов не предполагает, что эти анионы будут вести себя в растворе как кислоты (гидролиз гидроанионов и расчет отношения между ?1 и а2 изучаются только в высшей школе). Оснoвные соли MgCl(OH), Cu2CO3(OH)2 и другие в своем большинстве практически нерастворимы в воде, и обсуждать их поведение в водном растворе невозможно. 13.3. Диссоциация воды. Среда растворов Сама вода – это очень слабый электролит: 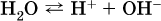 Концентрации катиона Н+ и аниона ОН- в чистой воде весьма малы и составляют 1 10-7 моль/л при 25 °C. Катион водорода Н+ представляет собой простейшее ядро – протон р+ (электронная оболочка катиона Н+ – пустая, 1s0). У свободного протона велики подвижность и проникающая способность, в окружении полярных молекул Н2O он не может оставаться свободным. Протон тут же присоединяется к молекуле воды: 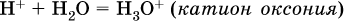 В дальнейшем для простоты оставляется запись Н+ (но подразумевается Н3O+). В воде содержание ионов Н+ и ОН одинаково; в водных растворах кислот появляется избыток ионов Н+, в водных растворах щелочей – избыток ионов ОН (за счет диссоциации кислот и оснований). Типы среды водных растворов: 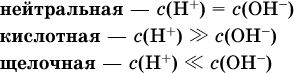 Содержание Н+ и ОН- в водных растворах обычно выражают через водородный показатель рН (читается пэ-аш) и аналогичный ему гидроксильный показатель рОН: 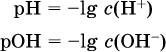 Для воды при комнатной температуре имеем: 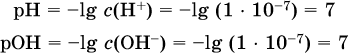 следовательно, в чистой воде: 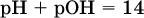 Это равенство справедливо и для водных растворов: 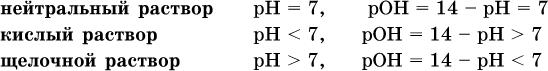 Практическая шкала рН отвечает интервалу 1—13 (разбавленные растворы кислот и оснований): 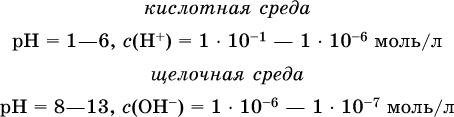 В практически нейтральной среде с рН = 6–7 и рН = 7–8 концентрация Н+ и ОН- очень мала (1 10-6 – 1 • 10-7 моль/л) и почти равна концентрации этих ионов в чистой воде. Такие растворы кислот и оснований считаются предельно разбавленными (содержат очень мало вещества). Для практического установления типа среды водных растворов служат индикаторы – вещества, которые окрашивают в характерный цвет нейтральные, кислые и/или щелочные растворы. Распространенные в лаборатории индикаторы – это лакмус, метилоранж и фенолфталеин. Метилоранж (индикатор на кислотную среду) становится розовым в сильнокислом растворе (табл. 16), фенолфталеин (индикатор на щелочную среду) – малиновым в сильнощелочном растворе, а лакмус используется во всех средах. 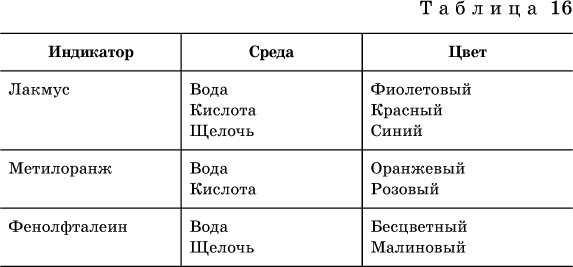 13.4. Реакции ионного обмена В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно-восстановительные реакции). Примеры, приводимые далее, относятся к обменным реакциям (о протекании окислительно-восстановительных реакций см. разд. 14). В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в виде газов) или растворимые вещества – слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений — молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены (читателю предлагается составить их самому). При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости (см. табл. 8). Примеры реакций с выпадением осадков: а) 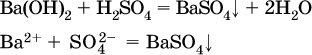 б) 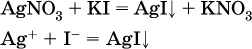 в) 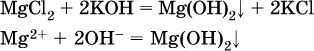 г) 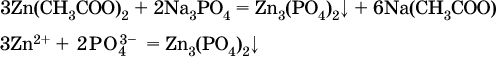 Внимание! Указанные в таблице растворимости (см. табл. 15) малорастворимые («м») и практически нерастворимые («н») соли выпадают в осадок именно в том виде, как они представлены в таблице (СаF2v, PbI2v, Ag2SO4v, AlPO4v и т. д.). В табл. 15 не указаны карбонаты – средние соли с анионом CO32-. Следует иметь в виду, что: 1) К2СO3, (NH4)2CO3 и Na2CO3 растворимы в воде; 2) Ag2CO3, ВаСO3 и СаСO3 практически нерастворимы в воде и выпадают в осадок как таковые, например: 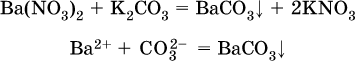 3) соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимы в воде, но не осаждаются из водного раствора при проведении ионных реакций (т. е. их нельзя получить этим способом). Например, карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и К2СO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ: 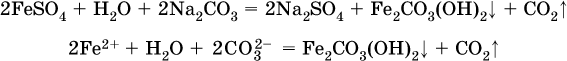 Аналогично FeCO3, сульфид хрома (III) Cr2S3 (нерастворимый в воде) не осаждается из раствора: 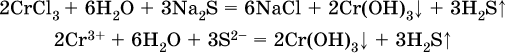 В табл. 15 не указаны также соли, которые разлагаются водой — сульфид алюминия Al2S3 (а также BeS) и ацетат хрома (III) Cr(СН3СОО)3: 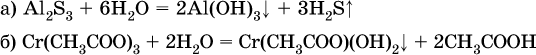 Следовательно, эти соли также нельзя получить по обменной реакции в растворе: 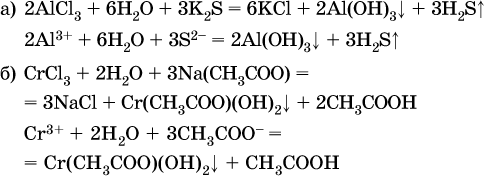 (в последней реакции состав осадка более сложный; подробнее такие реакции изучают в высшей школе). Примеры реакций с выделением газов: 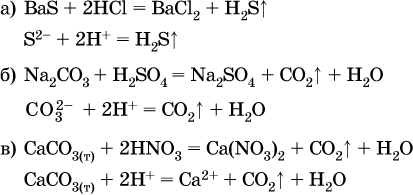 Примеры реакций с образованием слабых электролитов: 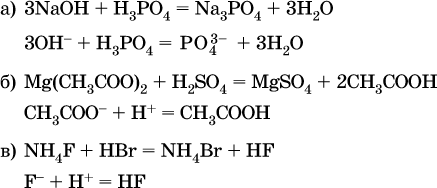 Если реагенты и продукты обменной реакции не являются сильными электролитами, ионный вид уравнения отсутствует, например: 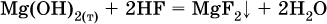 13.5. Гидролиз солей Гидролиз соли – это взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа (ниже речь идет о средних солях). Процесс гидролиза протекает только с участием растворимых солей и состоит из двух этапов: 1) диссоциация соли в растворе – необратимая реакция (степень диссоциации ? = 1, или 100 %); 2) собственно гидролиз, т. е. взаимодействие ионов соли с водой, – обратимая реакция (степень гидролиза ? < 1, или 100 %). Уравнения 1-го и 2-го этапов – первый из них необратим, второй обратим – складывать нельзя! Отметим, что соли, образованные катионами щелочей и анионами сильных кислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей КCl, NaNO3, Na2SO4 и BaI2 среда нейтральная. В случае взаимодействия аниона растворенной соли с водой процесс называется гидролизом соли по аниону. 1) 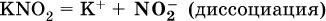 2) 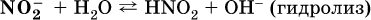 Диссоциация соли KNO2 протекает полностью, гидролиз аниона NO2 – в очень малой степени (для 0,1М раствора – на 0,0014 %), но этого оказывается достаточно, чтобы раствор стал щелочным (среди продуктов гидролиза присутствует ион ОН-), в нем рН = 8,14. Гидролизу подвергаются анионы только слабых кислот (в данном примере – нитрит-ион NO2-, отвечающий слабой азотистой кислоте HNO2). Анион слабой кислоты притягивает к себе катион водорода, имеющийся в воде, и образует молекулу этой кислоты, а гидроксид-ион остается свободным: 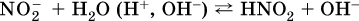 Список гидролизующихся анионов: 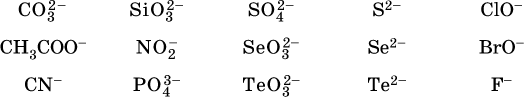 Примеры: а) 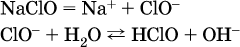 б) 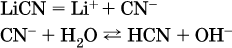 в) 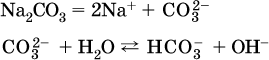 г) 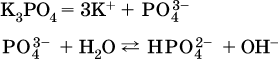 д) 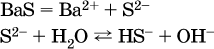 Обратите внимание, что в примерах (в – д) нельзя увеличивать число молекул воды и вместо гидроанионов (HCO3-, HPO42-, HS-) писать формулы соответствующих кислот (Н2СO3, Н3РO4, H2S). Гидролиз – обратимая реакция, и протекать «до конца» (до образования кислоты НnА) он не может. Если бы такая неустойчивая кислота, как Н2СO3, образовалась в растворе своей соли Na2CO3, то наблюдалось бы выделение из раствора газа СO2 (Н2СO3 = СO2v + Н2O). Однако при растворении соды в воде образуется прозрачный раствор без газовыделения, что является свидетельством неполноты протекания гидролиза аниона СО| с появлением в растворе только гидроаниона угольной кислоты HCOg. Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза – кислоты (HNO2, НClO, HCN) или ее гидроаниона (HCO3-, HPO42-, HS-); чем слабее кислота, тем выше степень гидролиза. Например, ионы СО32-, РО43- и S2- подвергаются гидролизу в большей степени (в 0,1 М растворах ~ 5 %, 37 % и 58 % соответственно), чем ион NO2, так как диссоциация Н2СO3 и H2S по 2-й ступени, а Н3РO4 по 3-й ступени (т. е. диссоциация ионов HCO3-, HS- и HPO42-) протекает значительно меньше, чем диссоциация кислоты HNO2. Поэтому растворы, например, Na2CO3, К3РO4 и BaS будут сильнощелочными (в чем легко убедиться по мылкости раствора соды на ощупь). Избыток ионов ОН в растворе легко обнаружить индикатором или измерить специальными приборами (рН-метрами). Если в концентрированный раствор сильно гидролизующейся по аниону соли, например Na2CO3, внести алюминий, то последний (вследствие амфотерности) прореагирует с ОН- 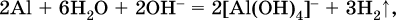 и будет наблюдаться выделение водорода. Это – дополнительное доказательство протекания гидролиза иона СО32- (ведь в раствор Na2CO3 мы не добавляли щелочь NaOH!). В случае взаимодействия катиона растворенной соли с водой процесс называется гидролизом соли по катиону: 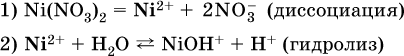 Диссоциация соли Ni(NO3)2 протекает полностью, гидролиз катиона Ni2+ – в очень малой степени (для 0,1 М раствора – на 0,001 %), но этого оказывается достаточно, чтобы раствор стал кислым (среди продуктов гидролиза присутствует ион Н+), в нем рН = 5,96. Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH4+. Гидролизуемый катион притягивает к себе анион ОН-, имеющийся в воде, и образует соответствующий гидроксокатион, а катион Н+ остается свободным: 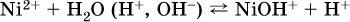 Катион аммония в этом случае образует слабое основание – гидрат аммиака: 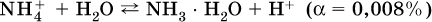 Список гидролизующихся катионов: 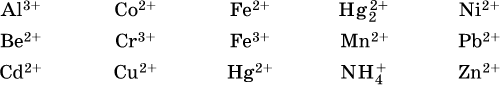 Примеры: а) 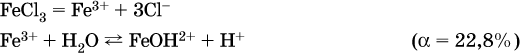 б) 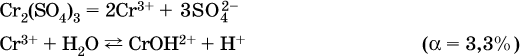 в) 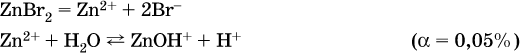 г) 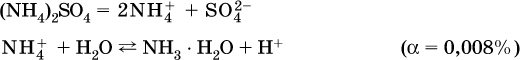 Обратите внимание, что в примерах (а – в) нельзя увеличивать число молекул воды и вместо гидроксокатионов FeOH2+, CrOH2+, ZnOH+ писать формулы гидроксидов FeO(OH), Cr(OH)3, Zn(OH)2. Если бы гидроксиды образовались, то из растворов солей FeCl3, Cr2(SO4)3 и ZnBr2 выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы). Избыток катионов Н+ легко обнаружить индикатором или измерить специальными приборами. Можно также проделать такой опыт. В концентрированный раствор сильно гидролизующейся по катиону соли, например AlCl3: 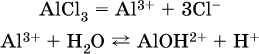 вносится магний или цинк. Последние прореагируют с Н+: 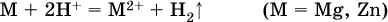 и будет наблюдаться выделение водорода. Этот опыт – дополнительное свидетельство протекания гидролиза катиона Al3+ (ведь в раствор AlCl3 мы не добавляли кислоту!). Примеры заданий частей А, В1. Сильный электролит – это 1) С6Н5ОН 2) СН3СООН 3) С2Н4(ОН)2 4) К(НСОО) 2. Слабый электролит – это 1) иодоводород 2) фтороводород 3) сульфат аммония 4) гидроксид бария 3. В водном растворе их каждых 100 молекул образуется 100 катионов водорода для кислоты 1) угольной 2) азотистой 3) азотной 4) серной 4—7. В уравнении диссоциации слабой кислоты по всем возможным ступеням 4. Н3РO4 5. H2SeO3 6. H4SiO4 7. HF сумма коэффициентов равна 1) 3 2) 6 3) 9 4) 12 8—11. Для уравнений диссоциации в растворе двух щелочей набора 8. NaOH, Ва(ОН)2 9. Sr(OH)2, Са(ОН)2 10. КОН, LiOH 11. CsOH, Са(ОН)2 общая сумма коэффициентов составляет 1) 5 2) 6 3) 7 4) 8 12. В известковой воде содержится набор частиц 1) СаОН+, Са2+, ОН- 2) Са2+, ОН-, Н2O 3) Са2+, Н2O, О2- 4) СаОН+, О2-, Н+ 13—16. При диссоциации одной формульной единицы соли 13. NH4NO3 14. К2Cr2O7 15. Al(NO3)3 16. Cr2(SO4)3 число образующихся ионов равно 1) 2 2) 3 3) 4 4) 5 17. Наибольшее количество иона РО4-3 можно обнаружить в растворе, содержащем 0,1 моль 1) NaH2PO4 2) NaHPO4 3) Н3РO4 4) Na3PO4 18. Реакция с выпадением осадка – это 1) MgSO4 + H2SO4 >… 2) AgF + HNO3 >… 3) Na2HPO4 + NaOH >… 4) Na2SiO3 + HCl >… 19. Реакция с выделением газа – это 1) NaOH + СН3СООН >… 2) FeSO4 + КОН >… 3) NaHCO3 + HBr >… 4) Pl(NO3)2 + Na2S >… 20. Краткое ионное уравнение ОН- + Н+ = Н2O отвечает взаимодействию 1) Fe(OH)2 + НCl >… 2) NaOH + HNO2 >… 3) NaOH + HNO3 >… 4) Ва(ОН)2 + KHSO4 >… 21. В ионном уравнении реакции SO2 + 2OН = SO32- + Н2O ион ОН- может отвечать реагенту 1) Cu(ОН)2 2) Н2O 3) LiOH 4) С6Н5ОН 22—23. Ионное уравнение 22. ЗСа2+ + 2РO43- = Са3(РO4)2v 23. Са2+ + НРO42- = СаНРO4v соответствует реакции между 1) Са(ОН)2 и К3РO4 2) СаCl2 и NaH2PO4 3) Са(ОН)2 и Н3РО4 4) СаCl и К2НРO4 24—27. В молекулярном уравнении реакции 24. Na3PO4 + AgNO3 >… 25. Na2S + Cu(NO3)2 >… 26. Ca(HSO3)2 [p-p, t] >… 27. K2SO3 + 2HBr >… сумма коэффициентов равна 1) 4 2) 5 3) 7 4) 8 28—29. Для реакции полной нейтрализации 28. Fe(OH)2 + HI >… 29. Ва(ОН)2 + H2S >… сумма коэффициентов в полном ионном уравнении составляет 1) 6 2) 8 3) 10 4) 12 30—33. В кратком ионном уравнении реакции 30. NaF + AlCl3 >… 31. К2СO3 + Sr(NO3)2 >… 32. Mgl2 + К3РO4 >… 33. Na2S + H2SO4 >… сумма коэффициентов равна 1) 3 2) 4 3) 5 4) 6 34—36. В водном растворе соли 34. Са(ClO4)2 35. AgF 36. Fe2(SO4)3 образуется среда 1) кислотная 2) нейтральная 3) щелочная 4) любая 37. Концентрация гидроксид-иона увеличивается после растворения в воде соли 1) CsNO3 2) SrCl2 3) NaCN 4) KHSO4 38. Нейтральная среда будет в конечном растворе после смешивания растворов исходных солей в наборах 1) ВаCl2, Fe(NO3)3 2) Na2CO3, SrS 3) BaS, ZnSO4 4) MgCl2, RbNO3 39. Установите соответствие между солью и ее способностью к гидролизу. 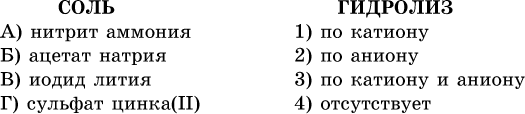 40. Установите соответствие между солью и средой раствора. 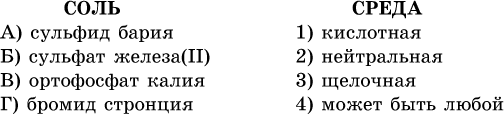 41. Установите соответствие между солью и концентрацией катиона водорода после растворения соли в воде. 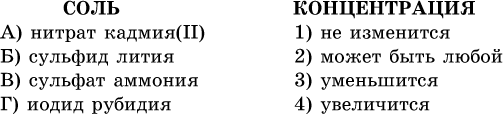 |
|
||

 » – вещество смешивается с водой неограниченно
» – вещество смешивается с водой неограниченно