|
||||
|
|
14. Окислительно-восстановительные реакции. Электролиз 14.1. Окислители и восстановители Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов: 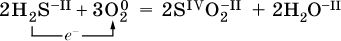 Повышение степени окисления элемента в ходе реакции, отвечающее потере электронов атомами этого элемента, называют окислением: S-II – 6е- = SIV. В данном примере S-II окисляется до SIV. Понижение степени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением: O0 + 2е- = О-II. В данном примере О0 восстанавливается до O-II. Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя. В данном примере восстановитель – сероводород H2S. Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функцию окислителя. В данном примере окислитель – молекулярный кислород O2. Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными). Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления: 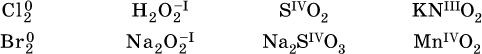 Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают бoльшими окислительными свойствами, а металлы – бoльшими восстановительными свойствами (O2, Cl2 – окислители; Na, Ва, Al и Zn – восстановители). В каждой группе Периодической системы элемент с большим порядковым номером будет обладать и бoльшими восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером – бoльшими окислительными свойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl2 – более сильный окислитель, чем иод I2. Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH3 – восстановитель за счет азота (-III), H2S – за счет серы (-II), KI – за счет иода (-I) и т. д. Соединения, включающие атомы элементов в высокой степени окисления, будут окислителями, например: HNO3 – окислитель за счет азота (+V), КMnO4 – за счет марганца (+VII), К2Cr2O7 – за счет хрома (+VI) и т. д. 14.2. Подбор коэффициентов методом электронного баланса Метод состоит из нескольких этапов. 1. Записывают схему реакции; находят элементы, повышающие и понижающие свои степени окисления, и выписывают их отдельно: 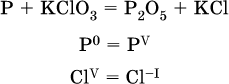 2. Составляют уравнения полуреакций окисления и восстановления: 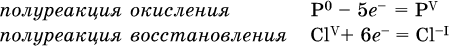 3. Подбирают дополнительные множители (справа за чертой) для уравнений полуреакций так, чтобы число электронов, отданных восстановителем, стало равным числу электронов, принятых окислителем: 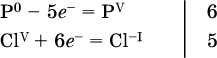 4. Проставляют найденные множители в качестве коэффициентов в схему реакции: 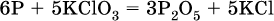 5. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего – кислород): 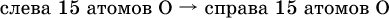 Примеры: а) 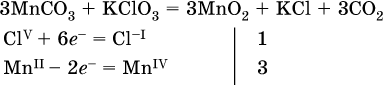 (коэффициент перед СO2 подбирается поэлементно и в последнюю очередь, проверка – по кислороду); б) 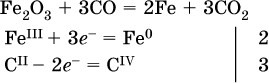 в) 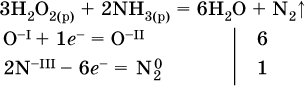 (простые вещества – здесь N2 – пишут в уравнениях полуреакций в молекулярном виде); г) 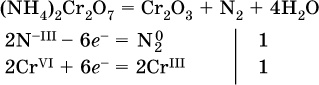 (реакция внутримолекулярного окисления-восстановления, расчет ведут на число атомов в формульной единице реагента – 2N-IIIи 2CrVI); д) 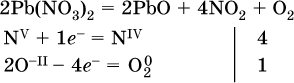 e) 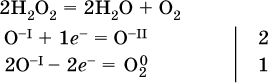 (реакция дисмутации, коэффициенты ставят сначала в правую часть уравнения); ж) 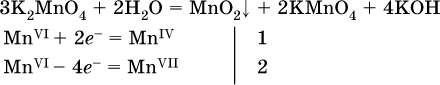 (коэффициент перед К2MnO4 находят суммированием числа атомов MnVI в правой части обоих уравнений полуреакций); з) 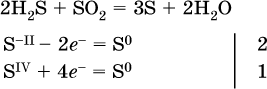 (реакция конмутации, коэффициенты ставят сначала в левую часть уравнения); и) 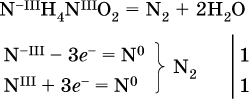 к) 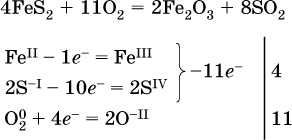 (в FeS2 окисляются атомы FeII FeIII и S-I > SIV, расчет ведут на число этих атомов в формульной единице реагента и суммируют число отданных электронов); л) 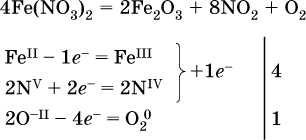 (в реагенте одновременно окисляются атомы первого слева и восстанавливаются атомы второго слева элементов: FeII > FeIII и NV > NIV, расчет ведут на число этих атомов в формуле реагента и алгебраически суммируют число электронов); м) 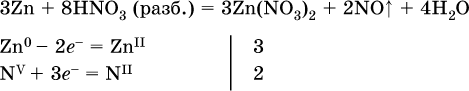 (коэффициент для HNO3 находят суммированием числа атомов N в правой части уравнения); н) 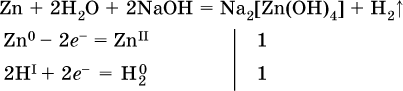 (в растворе Zn – восстановитель, H2O – окислитель; в молекуле воды восстанавливается один атом водорода из двух: НIОН – Н0);  (в расплаве восстанавливается атом водорода из гидроксид-иона [ОНI]- > Н0). 14.3. Ряд напряжений металлов В ряду напряжений металлов стрелка отвечает уменьшению восстановительной способности металлов и увеличению окислительной способности их катионов в водном растворе (кислотная среда): 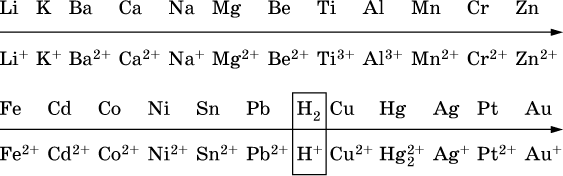 Ряд напряжений позволяет установить: 1) будет ли протекать реакция между металлом и водой; металлы, стоящие в ряду левее Mg, т. е. Li, К, Ва, Са и Na, реагируют с водой по уравнениям: 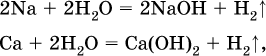 остальные металлы в обычных условиях не реагируют с водой; 2) будет ли протекать реакция с выделением Н2 между металлом и кислотой, которая является окислителем за счет катионов Н+, такими как НCl и H2SO4 (разб.). С НCl (разб.) и H2SO4 (разб.) реагируют почти все металлы, стоящие левее водорода, например: 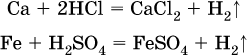 Исключения: металлы Ti и Sn реагируют только с НCl (конц.): 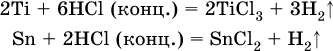 и не реагируют с H2SO4 (разб.). Металл Pb, восстановительная активность которого почти равна таковой для водорода, не реагирует с НCl (разб., конц.) и H2SO4 (разб.). Металлы, стоящие в ряду напряжений правее водорода – Cu, Hg, Ag, Pt и Au, в принципе не вступают во взаимодействие с НCl и H2SO4 (разб.) и не вытесняют из них водорода. Внимание! Из распространенных кислот в реакции с вытеснением водорода не вступают азотная кислота HNO3 (ни концентрированная, ни разбавленная) и серная кислота H2SO4 (конц.); 3) будет ли протекать реакция замещения между металлом и солью другого металла в ее растворе; чем левее находится металл в ряду напряжений, тем легче он переходит в состояние катиона и восстанавливает все металлы, стоящие справа от него (положение металлов относительно водорода не имеет значения). Так, Fe вытесняет металлы Cd – Au (по ряду слева направо) из растворов их солей. Примеры: а) 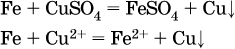 б) 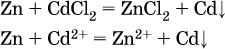 в) 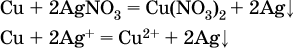 В этих реакциях не используют металлы Li – Na (левая часть ряда), которые будут реагировать не с солями других металлов в растворе, а с водой. 14.4. Электролиз расплава и раствора Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде — катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде — аноде идет электрохимическое окисление частиц (атомов, молекул, анионов). Примеры электролиза расплавов: а) 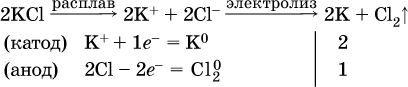 б) 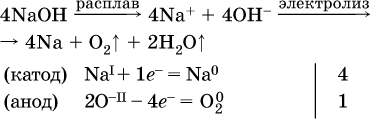 Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита – воды): 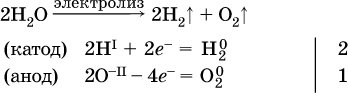 В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде (например, в присутствии K2SO4, H2SO4 или КОН). При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например, Li+, К+, Са2+, Na+, Mg2+, Al3+), и никогда не окисляется на аноде кислород О-II анионов оксокислот с элементом в высшей степени окисления (например, ClO4-, SO42-, NO3-, РО43-, CO32-); вместо них окисляется вода. Примеры электролиза растворов солей: а) 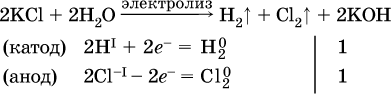 (на аноде окисляются анионы Cl-, а не кислород О-II молекул Н2O, так как электроотрицательность хлора меньше, чем у кислорода, и следовательно, хлор отдает электроны легче, чем кислород); б) 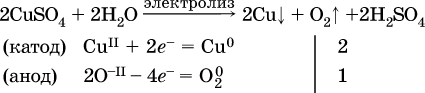 (на катоде восстанавливаются катионы Cu2+, а не водород НI молекул Н2O, так как медь стоит правее водорода в ряду напряжений, т. е. легче принимает электроны, чем НI в воде; подробнее см. 5.3). Подчеркнем еще раз, что электролиз – это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут. Примеры заданий частей А, В, С1. В уравнении реакции CuS + HNO3 (конц.) > CuSO4 + NO2^ +… коэффициент у формулы окислителя равен 1) 1 2) 4 3) 8 4) 11 2. В уравнении реакции К2Cr2O7 + НCl > CrCl3 + Cl2^ +… коэффициент у формулы восстановителя – это 1) 14 2) 10 3) 6 4) 2 3?4. В уравнении реакции 3. Al + V2O5 > Al2O3 + V 4. MgC2 + Cl2 > MgCl2 + СCl4 сумма коэффициентов равна 1) 8 2) 13 3) 18 4) 24 5—6. В уравнении реакции 5. КMnО4 + Н2O + K2SO4 > MnO2v + K2SO4 + KOH 6. KI + H2O + Cl2 > KIO3 + HCl сумма коэффициентов равна 1) 9 2) 10 3) 13 4) 14 7. Укажите соответствие между веществом (формула подчеркнута) и его функцией в реакции. 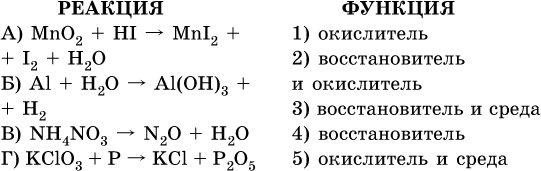 8. При электролизе расплава смеси гидроксида и хлорида калия набор продуктов на электродах – это 1) Н2, O2 2) К, O2 3) K, Cl2 4) Н2, Cl2 9. При электролизе раствора нитрата ртути (II) набор продуктов на электродах – это 1) Hg, O2 2) H2, O2 3) Hg, N2 4) H2, N2 10. Установите соответствие между веществом и продуктом, образующимся на катоде при электролизе раствора  11. Установите соответствие между веществом и продуктом, образующимся на аноде при электролизе раствора  12—14. Используя метод электронного баланса, составьте уравнение реакции по указанной схеме. Определите окислитель и восстановитель. 12. Mn(NO3)2 + HNO3 + РЬO2 > HMnO4 + Pb(NO3)2 +… 13. Zn + H2SO4 + HNO3 (разб.) > ZnSO4 + NO +… 14. K2Cr2O7 + HCl + C2H5OH > CrCl3 + CH3C(H)O +… |
|
||
