|
||||
|
|
7. Неметаллы главных подгрупп IV–VII групп 7.1. Водород Водород – первый элемент Периодической системы (1-й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе (в таблицах условно помещается в IA– и/или в VIIA-группу). Атом водорода наименьший по размерам и самый легкий среди атомов всех элементов. Электронная формула атома 1s1, характерные степени окисления 0, +I и реже – I. Состояние HI считается устойчивым (соединения с H-I – сильные восстановители). Шкала степеней окисления водорода: 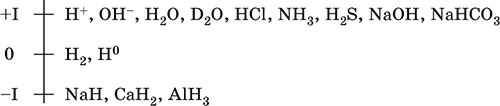 По электроотрицательности (2,10) водород занимает промежуточное положение между типичными металлами и типичными неметаллами. Проявляет амфотерные свойства – металлические и неметаллические. Входит в состав катионов (катионы оксония Н3O+ и аммония NH4+, аквакатионы металлов) и многочисленных анионов – кислых кислотных остатков (HS-, HCO3- и др.). Природный водород содержит изотоп 1Н — протий с примесью стабильного изотопа 2H(D) – дейтерия и следами радиоактивного изотопа 3Н(Т) – трития (на Земле всего 2 кг трития). В химии символом Н в формулах веществ обозначается содержащаяся в них природная смесь изотопов с преобладанием изотопа протий, а сами вещества рассматриваются как почти изотопночистые соединения протия. Водород – наиболее распространенный элемент в космосе (Солнце, большие планеты Юпитер и Сатурн, звезды, межзвездная среда, туманности); в состав космической материи входит 63 % Н, 36 % Не и 1 % всех остальных элементов. В природе – третий по химической распространенности элемент (после О и Si), основа гидросферы. Встречается в химически связанном виде (вода, живые организмы, нефть, природный уголь, минералы), содержится в верхних слоях атмосферы. Водород Н2. Простое вещество. Бесцветный газ без запаха и вкуса. Молекула содержит ковалентную ?-связь Н – Н. Очень легкий, термически устойчивый до 2000 °C. Весьма мало растворим в воде. Хемосорбируется металлами Fe, Ni, Pd, Pt, где находится в атомном состоянии. Водород Н2 может проявлять в одних условиях восстановительные свойства (чаще), в других – окислительные свойства (реже): восстановитель Н20 – 2е- = 2НI окислитель Н20 + 2е- = 2Н-I Сильный восстановитель при высоких температурах, водород реагирует с неметаллами и оксидами малоактивных металлов, выполняет роль окислителя в реакциях с типичными металлами: 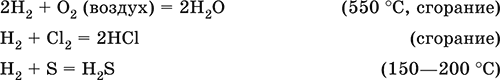  Очень высокой восстановительной способностью обладает атомарный водород Н0 (водород in statu nascendi, лат., – в момент возникновения), который получают непосредственно в зоне проводимой реакции (время жизни Н0 0,5 с); например, гранулы магния вносят в подкисленный раствор переманганата калия, протекают реакции: а) образование атомарного водорода Mg + 2Н+ = Mg2+ + 2Н0 б) восстановление перманганат-иона атомарным водородом 5Н0 + 3H+ + MnO4- = Mn2+ + 4Н2O Другой пример – восстановление нитробензола в анилин (реакция Зинина): а) Fe + 2Н+ = Fe2+ + 2Н0 б) C6H5NO2 + 6Н0 = C6H5NH2 + 2Н2O Получить атомарный водород можно также пропусканием водорода Н2 над никелевым катализатором. Атомарный водород легко восстанавливает при комнатной температуре весьма устойчивые соединения, например KNO3 и O2: 2Н0 (Zn, разб. HCl) + KNO3 = KNO2 + H2O 2H0 (Zn, разб. HCl) + O2 = Н2O2 Аналогично протекают реакции при использовании амфигенов (Zn, Al) в щелочной среде: а) Zn + 2OH- + 2H2O = [Zn(OH)4]2- + 2Н0 б) 8Н0 + KNO3 = NH3^ + КОН + 2Н2O (кипячение) Качественная реакция – сгорание собранного в пробирку водорода с «хлопком» («гремучая» смесь с воздухом при содержании Н2 4—74 % по объему). Применяется водород как восстановитель и гидрирующий агент в синтезе технически важных продуктов (редкие металлы, NH3, НCl, органические вещества). Вода Н2O. Бинарное соединение. Бесцветная жидкость (слой более 5 м толщиной окрашен в голубой цвет), без вкуса и запаха. Молекула имеет строение дважды незавершенного тетраэдра [:: ОН2] (sр3-гибридизация). Летучее вещество, термически устойчивое до 1000 °C. В обычных условиях полярные молекулы воды образуют между собой водородные связи. Это обусловливает аномалию температур плавления и кипения воды – они значительно выше, чем у ее химических аналогов (H2S и других). Затвердевание воды в лед сопровождается увеличением объема на 9 %, т. е. лед легче жидкой воды (вторая аномалия воды). Наибольшую плотность вода имеет не при 0 °C, а при 4 °C (третья аномалия воды). Твердая вода (лед) легко возгоняется. Природная вода по изотопному составу водорода в основном 1Н2O с примесью 1Н2НО и 2Н2O, по изотопному составу кислорода в основном Н216O с примесью Н218O и Н217O. В малой степени подвергается диссоциации до Н+, или, точнее, до Н3O+, и ОН; очень слабый электролит. Катион оксония Н3O+ имеет строение незавершенного тетраэдра [: O(Н)3] (sр3-гибридизация). Образует кристаллогидраты со многими солями, аквакомплексы – с катионами металлов. Реагирует с металлами, неметаллами, оксидами. Вызывает электролитическую диссоциацию кислот, оснований и солей, гидролизует многие бинарные соединения и соли. Подвергается электролизу в присутствии сильных электролитов. Почти универсальный жидкий растворитель неорганических веществ. Для химических целей природную воду очищают перегонкой (дистиллированная вода), для промышленных целей умягчают, устраняя «временную» и «постоянную» жесткость, или полностью обессоливают, пропуская через иониты в кислотной Н+-форме и щелочной ОН- – форме (ионы солей осаждаются на ионитах, а ионы Н+ и ОН- переходят в воду и взаимно нейтрализуются). Питьевую воду обеззараживают хлорированием (старый способ) или озонированием (современный, но дорогой способ; озон не только окисляет вредные примеси подобно хлору, но и увеличивает содержание растворенного кислорода). Уравнения важнейших реакций: 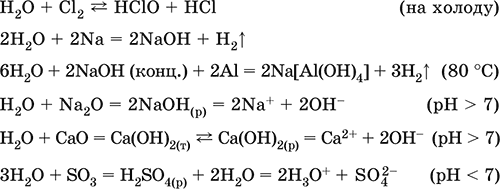 Примеры гидролиза бинарных соединений: 6H2O + Al2S3 = 2Al(ОН)3v + 3H2S^ 2H2O + SF4 = SO2^ + 4HF^ (40–60 °C) 6H2O + Mg3N2 = 3Mg(OH)2v + 2NH3^ (кипячение) 2H2O + CaC2 = Ca(OH)2v + C2H2^ Вода – окислитель за счет HI: 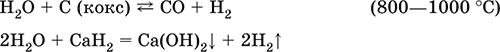 Электролиз воды: 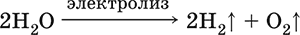 Электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз проводят в присутствии сильных электролитов. а) в нейтральном растворе (электролит Na2SO4) катод 2H2O + 2е- = H2^ + 2OH анод 2Н2O – 4е- = O2^ + 4H+ раствор ОН- + Н+ = Н2O б) в кислом растворе (электролит H2SO4) катод 2Н+ + 2е- = Н2^ анод 2Н2O – 4е- = O2^ + 4Н+ в) в щелочном растворе (электролит NaOH) катод 2Н2O + 2е- = Н2^ + 2OН- анод 4OН- – 4е- = O2^ + 2Н2O Один из методов обнаружения воды основан на переходе во влажной атмосфере белого сульфата меди(II) CuSO4 в голубой медный купорос CuSO4 5Н2O. Известна изотопная разновидность воды — тяжелая вода D2O (2Н2O); в природных водах массовое отношение D2O: Н2O = 1: 6000. Плотность, температуры плавления и кипения тяжелой воды выше, чем у обыкновенной. Растворимость большинства веществ в тяжелой воде значительно меньше, чем в обычной воде. Она ядовита, так как замедляет биологические процессы в живых организмах. Тяжелая вода накапливается в остатке электролита при многоразовом электролизе воды. Используется как теплоноситель и замедлитель нейтронов в ядерных реакторах. Гидрид кальция СаН2. Бинарное соединение. Белый, имеет ионное строение Са2+(Н-)2. При плавлении разлагается. Чувствителен к кислороду воздуха. Сильный восстановитель, реагирует с водой, кислотами. Применяется как твердый источник водорода (1 кг СаН2 дает 1000 л Н2), осушитель газов и жидкостей, аналитический реагент для количественного определения воды в кристаллогидратах. Уравнения важнейших реакций: СаН2 = Н2 + Са (особо чистый) (выше 1000 °C) СаН2 + 2Н2O = Са(ОН)2 + 2Н2^ СаН2 + 2НCl (разб.) = СаCl2 + 2Н2^ СаН2 + O2 = Н2O + СаО (особо чистый) (300–400 °C) ЗСаН2 + N2 = ЗН2 + Ca3N2 (выше 1000 °C) ЗСаН2 + 2КClO3 = 2КCl + ЗСаО + ЗН2O (450–550 °C) СаН2 + H2S = CaS + 2Н2 (500–600 °C) Получение: обработка нагретого кальция водородом. 7.2. Галогены 7.2.1. Хлор. Хлороводород Хлор – элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne]3s23p5, характерные степени окисления 0, -I, +I, +V и +VII. Наиболее устойчиво состояние Cl-I. Шкала степеней окисления хлора:  Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ – оксидов, кислот, солей, бинарных соединений. В природе – двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и H), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов. Хлор Cl2. Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Cl2 неполярна, содержит ?-связь CI–Cl. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре): 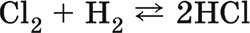 Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью – в щелочном растворе: 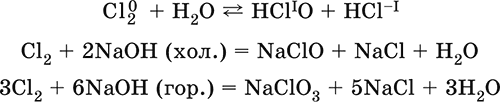 Раствор хлора в воде называют хлорной водой, на свету кислота НClO разлагается на НCl и атомарный кислород О0, поэтому «хлорную воду» надо хранить в темной склянке. Наличием в «хлорной воде» кислоты НСlO и образованием атомарного кислорода объясняются ее сильные окислительные свойства: например, во влажном хлоре обесцвечиваются многие красители. Хлор очень сильный окислитель по отношению к металлам и неметаллам: 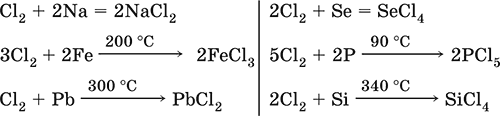 Реакции с соединениями других галогенов: а) Cl2 + 2KBr(p) = 2КCl + Br2^ (кипячение) б) Cl2 (нед.) + 2KI(p) = 2КCl + I2v 3Cl2 (изб.) + ЗН2O + KI = 6НCl + КIO3 (80 °C) Качественная реакция – взаимодействие недостатка Cl2 с KI (см. выше) и обнаружение иода по синему окрашиванию после добавления раствора крахмала. Получение хлора в промышленности: 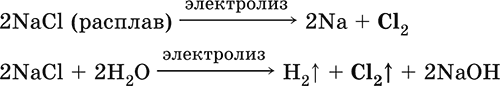 и в лаборатории: 4НCl (конц.) + MnO2 = Cl2^ + MnCl2 + 2Н2O (аналогично с участием других окислителей; подробнее см. реакции для НCl и NaCl). Хлор относится к продуктам основного химического производства, используется для получения брома и иода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит. Хлороводород НCl. Бескислородная кислота. Бесцветный газ с резким запахом, тяжелее воздуха. Молекула содержит ковалентную ?-связь Н – Cl. Термически устойчив. Очень хорошо растворим в воде; разбавленные растворы называются хлороводородной кислотой, а дымящий концентрированный раствор (35–38 %) – соляной кислотой (название дано еще алхимиками). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Сильный восстановитель в концентрированном растворе (за счет Cl-I), слабый окислитель в разбавленном растворе (за счет НI). Составная часть «царской водки». Качественная реакция на ион Cl- – образование белых осадков AgCl и Hg2Cl2, которые не переводятся в раствор действием разбавленной азотной кислоты. Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций: НCl (разб.) + NaOH (разб.) = NaCl + Н2O HCl (разб.) + NH3 H2O = NH4Cl + Н2O 4HCl (конц., гор.) + МО2 = МCl2 + Cl2^ + 2H2O (М = Mn, Pb) 16HCl (конц., гор.) + 2КMnO4(т) = 2MnCl2 + 5Cl2^ + 8H2O + 2КCl 14HCl (конц.) + К2Cr2O7(т) = 2CrCl3 + ЗCl2^ + 7H2O + 2КCl 6HCl (конц.) + КClO3(т) = КCl + ЗCl2^ + 3H2O (50–80 °C) 4HCl (конц.) + Са(ClO)2(т) = СаCl2 + 2Cl2| + 2Н2O 2HCl (разб.) + М = МCl2 + H2^ (М = Fe, Zn) 2HCl (разб.) + МСO3 = МCl2 + СO2^ + H2O (М = Са, Ва) HCl (разб.) + AgNO3 = HNO3 + AgClv Получение НCl в промышленности – сжигание Н2 в Cl2 (см.), в лаборатории – вытеснение из хлоридов серной кислотой: NaCl(т) + H2SO4 (конц.) = NaHSO4 + НCl^ (50 °C) 2NaCl(т) + H2SO4 (конц.) = Na2SO4 + 2НCl^ (120 °C) 7.2.2. Хлориды Хлорид натрия NaCl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе. Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство. В природе – основная часть залежей каменной соли, или галита, и сильвинита (вместе с КCl), рапы соляных озер, минеральных примесей морской воды (содержание NaCl = 2,7 %). В промышленности получают выпариванием природных рассолов. Уравнения важнейших реакций: 2NaCl(т) + 2H2SO4 (конц.) + MnO2(т) = Cl2^ + MnSO4 + 2Н2O + Na2SO4 (100 °C) 10NaCl(т) + 8H2SO4 (конц.) + 2КMnO4(т) = 5Cl2^ + 2MnSO4 + 8Н2O + 5Na2SO4 + K2SO4 (100 °C) 6NaCl(т) + 7H2SO4 (конц.) + К2Cr2O7(т) = ЗCl2 + Cr2(SO4)3 + 7Н2O + 3Na2SO4 + K2SO4 (100 °C) 2NaCl(т) + 4H2SO4 (конц.) + РЬO2(т) = Cl2^ + Pb(HSO4)2 + 2Н2O + 2NaHSO4 (50 °C) NaCl (разб.) + AgNO3 = NaNO3 + AgClv 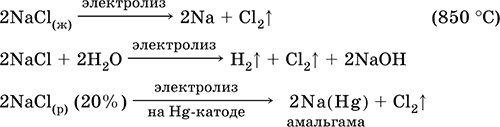 Хлорид калия KCl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Cl2. В природе основная составная часть (наравне с NaCl) залежей сильвинита. Уравнения важнейших реакций одинаковы с таковыми для NaCl. Хлорид кальция СаCl2. Бескислородная соль. Белый, плавится без разложения. Расплывается на воздухе за счет энергичного поглощения влаги. Образует кристаллогидрат СаCl2 6Н2O с температурой обезвоживания 260 °C. Хорошо растворим в воде, гидролиза нет. Вступает в реакции ионного обмена. Применяется для осушения газов и жидкостей, приготовления охлаждающих смесей. Компонент природных вод, составная часть их «постоянной» жесткости. Уравнения важнейших реакций: СаCl2(т) + 2H2SO4 (конц.) = Ca(HSO4)2 + 2НCl^ (50 °C) СаCl2(т) + H2SO4 (конц.) = CaSO4v + 2НCl^ (100 °C) СаCl2 + 2NaOH (конц.) = Ca(OH)2v + 2NaCl^ ЗСаCl2 + 2Na3PO4 = Са3(РO4)2v + 6NaCl СаCl2 + К2СO3 = СаСO3v + 2КCl СаCl2 + 2NaF = CaF2v + 2NaCl 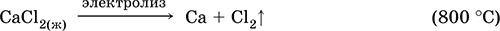 Получение: СаСO3 + 2HCl = СаCl2 + СO3^ + Н2O Хлорид алюминия AlCl3. Бескислородная соль. Белый, легкоплавкий, сильнолетучий. В паре состоит из ковалентных мономеров AlCl3 (треугольное строение, sр2-гибридизация, преобладают при 440–800 °C) и димеров Al2Cl6 (точнее, Cl2AlCl2AlCl2, строение – два тетраэдра с общим ребром, sр3-гибридизация, преобладают при 183–440 °C). Гигроскопичен, на воздухе «дымит». Образует кристаллогидрат, разлагающийся при нагревании. Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, создает в растворе сильнокислотную среду вследствие гидролиза. Реагирует со щелочами, гидратом аммиака. Восстанавливается при электролизе расплава. Вступает в реакции ионного обмена. Качественная реакция на ион Al3+ – образование осадка AlРO4, который переводится в раствор концентрированной серной кислотой. Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций: 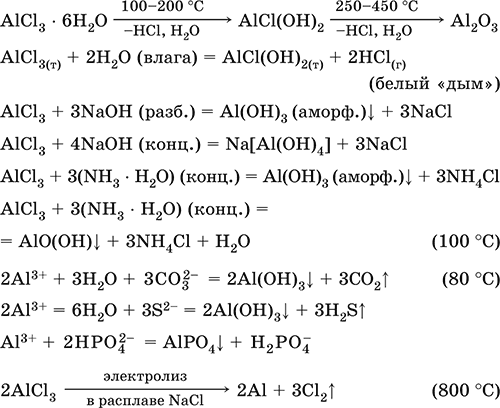 Получение AlCl3 в промышленности – хлорирование каолина, глинозёма или боксита в присутствии кокса: Al2O3 + ЗС (кокс) + ЗCl2 = 2AlCl3 + ЗСО (900 °C) Хлорид железа(Н) FeCl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке HCl. Связи Fe – Cl преимущественно ковалентные, пар состоит из мономеров FeCl2 (линейное строение, sp-гибридизация) и димеров Fe2Cl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования. Применяется для синтеза FeCl3 и Fe2O3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии. Уравнения важнейших реакций: 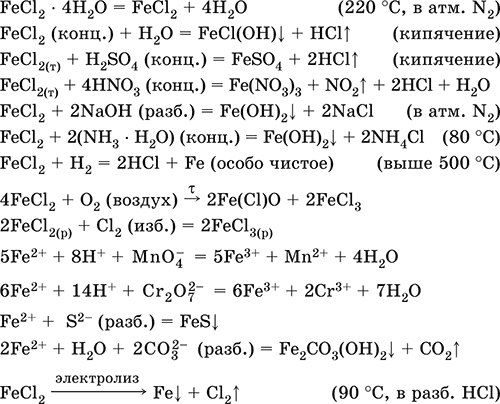 Получение: взаимодействие Fe с соляной кислотой: Fe + 2НCl = FeCl2 + Н2^ (в промышленности используют хлороводород и ведут процесс при 500 °C). Хлорид железа(III) FeCl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fe – Cl преимущественно ковалентные. Пар состоит из мономеров FeCl3 (треугольное строение, sр2-гибридизация, преобладают выше 750 °C) и димеров Fe2Cl6 (точнее, Cl2FeCl2FeCl2, строение – два тетраэдра с общим ребром, sр3-гибридизация, преобладают при 316–750 °C). Кристаллогидрат FeCl3 6Н2O имеет строение [Fe(H2O)4Cl2]Cl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель. Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов. Уравнения важнейших реакций: 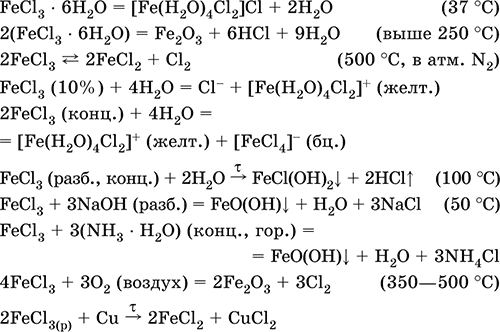 Хлорид аммония NH4Cl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию конмутации с нитратами. Качественная реакция на ион NH4+ – выделение NH3 при кипячении со щелочами или при нагревании с гашёной известью. Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий. Уравнения важнейших реакций: 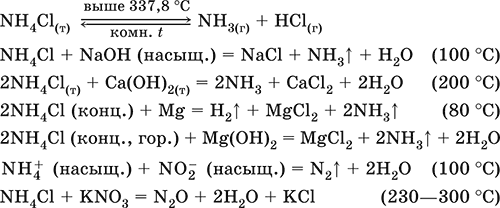 Получение: взаимодействие NH3 с HCl в газовой фазе или NH3 Н2O с HCl в растворе. 7.2.3. Гипохлориты. Хлораты Гипохлорит кальция Са(СlO)2. Соль хлорноватистой кислоты HClO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести – смеси неопределенного состава с СаCl2 и Са(ОН)2. Уравнения важнейших реакций: Са(ClO)2 = СаCl2 + O2 (180 °C) Са(ClO)2(т) + 4НCl (конц.) = СаCl2 + 2Cl2^ + 2Н2O (80 °C) Са(ClO)2 + Н2O + СO2 = СаСO3v + 2НClO (на холоду) Са(ClO)2 + 2Н2O2 (разб.) = СаCl2 + 2Н2O + 2O2^ Получение: 2Са(ОН)2 (суспензия) + 2Cl2(г) = Са(ClO)2 + СаCl2 + 2Н2O Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении. Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории – твердый источник кислорода. Уравнения важнейших реакций: 4КClO3 = ЗКClO4 + КCl (400 °C) 2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2) КClO3(т) + 6НCl (конц.) = КCl + ЗCl2| + ЗН2O (50–80 °C) ЗКClO3(т) + 2H2SO4 (конц., гор.) = 2ClO2| + КClO4 + Н2O + 2KHSO4 (диоксид хлора на свету взрывается: 2ClO2(г) = Cl2 + 2O2) 2КClO3 + Е2(изб.) = 2КЕO3 + Cl2^ (в разб. HNO3, Е = Br, I) 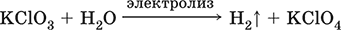 Получение КClO3 в промышленности – электролиз горячего раствора КCl (продукт КClO3 выделяется на аноде): 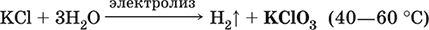 7.2.4. Бромиды. Иодиды Бромид калия КBr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем KI). Качественная реакция на ион Br – вытеснение брома из раствора КBr хлором и экстракция брома в органический растворитель, например СCl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет). Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство. Уравнения важнейших реакций: 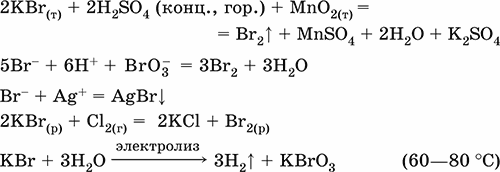 Получение: K2CO3 + 2HBr = 2KBr + CO2^ + H2O Иодид калия KI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор KI хорошо растворяет I2 за счет комплексообразования. Качественная реакция на ион I – вытеснение иода из раствора KI недостатком хлора и экстракция иода в органический растворитель, например СCl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет). Уравнения важнейших реакций: 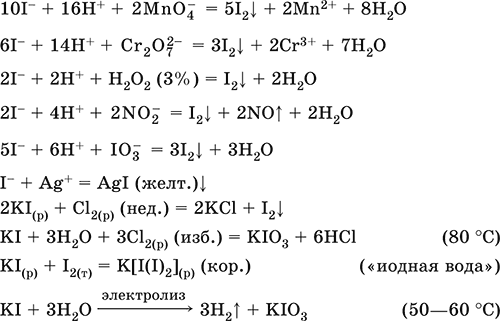 Получение: K2CO3 + 2HI = 2KI + СO2^ + Н2O 7.3. Халькогены 7.3.1. Кислород Кислород – элемент 2-го периода и VIA-группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым. Шкала степеней окисления кислорода: 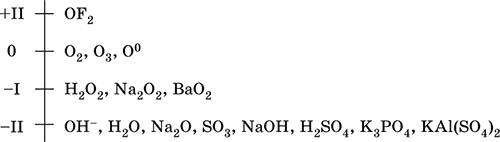 Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот. Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно-чистые соединения кислорода-16. Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов. Кислород O2. Простое вещество. Состоит из неполярных молекул О2 (дикислород) с ??-связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло-голубой, в твердом – синий. Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает после азота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из-за прочности двойной связи в молекулах. Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:  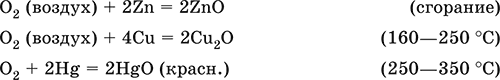 Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ. Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода. Получение кислорода: а) в промышленности – фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12); б) в лаборатории – нагревание легко разлагающихся кислородсодержащих веществ: 2HgO = 2Hg + O2 (450–500 °C) 2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C) 2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум) 2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2) 2KNO3 = 2KNO2 + O2 (400–520 °C) Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике. Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов. Озон O3. Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло-синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2-гибридизация, валентный угол 117°), содержит ковалентные ??-связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево-красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе — озонаторе. Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций: 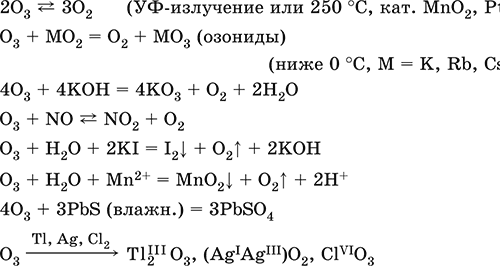 Получение: под действием электрического разряда в озонаторе: 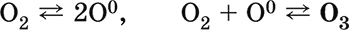 Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения. Атомарный кислород О0. Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их: KNO3 = KNO2 + O0 О0 + С (графит) = СO2 Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства. Пероксид водорода Н2O2. Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с ?-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой. 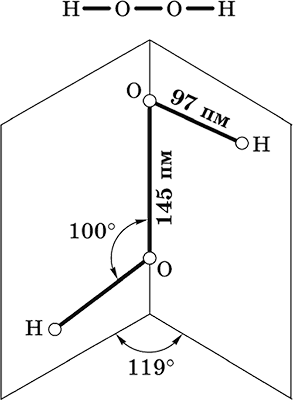 Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель. Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %-ный раствор Н2O2 (пергидроль), в медицине – 3 %-ный раствор. Уравнения важнейших реакций: 2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2) Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O Н2O2 (конц.) + 2NaOH(т) = Na2O2v + 2H2O (0 °C) Н2O2 (3 %) + 2H+ + 2I- = I2v + 2Н2O 5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O Н2O2 (10 %) + SO32- = SO32- + H2O 4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)v 3H2O2 + 2[Cr(OH)6]3- = 2CrO42- + 8H2O + 2OH- 2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2^ 5H2O2 + 6H+ + 2MnO4- = 2Mn2+ + 5O2^ + 8Н2O Получение: в лаборатории вначале синтезируют пероксид бария ВаO2: 2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C), а затем его обрабатывают серной кислотой: ВаO2 + H2SO4 = BaSO4v + Н2O2 (на холоду) В промышленности (старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2: 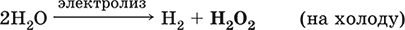 Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2-этилантрагидрохинон кислородом воздуха на холоду. 7.3.2. Сера. Сероводород. Сульфиды Сера – элемент 3-го периода и VIA-группы Периодической системы, порядковый номер 16, относится к халькогенам. Электронная формула атома [10Ne]3s23p4, характерные степени окисления 0, -II, +IV и +VI, состояние SVI считается устойчивым. Шкала степеней окисления серы: 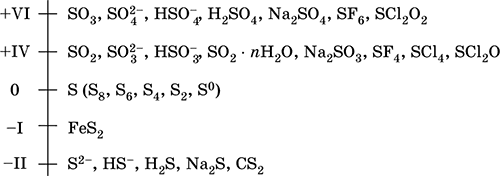 Электроотрицательность серы равна 2,60, для нее характерны неметаллические свойства. В водородных и кислородных соединениях находится в составе различных анионов, образует кислородсодержащие кислоты и их соли, бинарные соединения. В природе – пятнадцатый по химической распространенности элемент (седьмой среди неметаллов). Встречается в свободном (самородном) и связанном виде. Жизненно важный элемент для высших организмов. Сера S. Простое вещество. Желтая кристаллическая (?-ромбическая и ?-моноклинная, Сера не растворяется в воде и при обычных условиях не реагирует с ней, хорошо растворима в сероуглероде CS2. Сера, особенно порошкообразная, обладает высокой активностью при нагревании. Реагирует как окислитель с металлами и неметаллами: 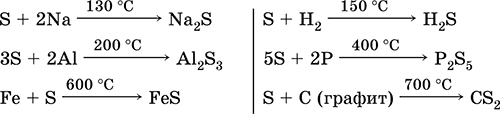 а как восстановитель – с фтором, кислородом и кислотами (при кипячении): 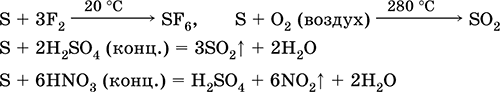 Сера подвергается дисмутации в растворах щелочей: 3S0 + 6КОН (конц.) = 2K2S-II + K2SIVO3 + 3H2O При высокой температуре (400 °C) сера вытесняет иод из иодоводорода: S + 2НI(г) = I2 + H2S, но в растворе реакция идет в обратную сторону: I2 + H2S(p) = 2 HI + Sv Получение: в промышленности выплавляется из природных залежей самородной серы (с помощью водяного пара), выделяется при десульфурации продуктов газификации угля. Сера применяется для синтеза сероуглерода, серной кислоты, сернистых (кубовых) красителей, при вулканизации каучука, как средство защиты растений от мучнистой росы, для лечения кожных заболеваний. Сероводород H2S. Бескислородная кислота. Бесцветный газ с удушающим запахом, тяжелее воздуха. Молекула имеет строение дважды незавершенного тетраэдра [::S(H)2] (sp3-гибридизация, валетный угол Н – S—Н далек от тетраэдрического). Неустойчив при нагревании выше 400 °C. Малорастворим в воде (2,6 л/1 л Н2O при 20 °C), насыщенный раствор децимолярный (0,1М, «сероводородная вода»). Очень слабая кислота в растворе, практически не диссоциирует по второй стадии до ионов S2- (максимальная концентрация S2- равна 1 10-13 моль/л). При стоянии на воздухе раствор мутнеет (ингибитор – сахароза). Нейтрализуется щелочами, не полностью – гидратом аммиака. Сильный восстановитель. Вступает в реакции ионного обмена. Сульфидирующий агент, осаждает из раствора разноокрашенные сульфиды с очень малой растворимостью. Качественные реакции – осаждение сульфидов, а также неполное сгорание H2S с образованием желтого налета серы на внесенном в пламя холодном предмете (фарфоровый шпатель). Побочный продукт очистки нефти, природного и коксового газа. Применяется в производстве серы, неорганических и органических серосодержащих соединений как аналитический реагент. Чрезвычайно ядовит. Уравнения важнейших реакций: 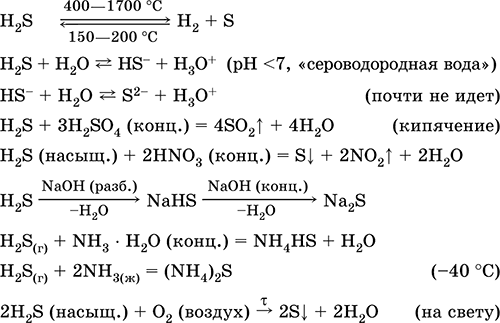  Получение: в промышленности – прямым синтезом: Н2 + S = H2S (150–200 °C) или при нагревании серы с парафином; в лаборатории – вытеснением из сульфидов сильными кислотами FeS + 2НCl (конц.) = FeCl2 + H2S^ или полным гидролизом бинарных соединений: Al2S3 + 6Н2O = 2Al(ОН)3v + 3H2S^ Сульфид натрия Na2S. Бескислородная соль. Белый, очень гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена. Качественные реакции на ион S2- – осаждение разноокрашенных сульфидов металлов, из которых MnS, FeS, ZnS разлагаются в НCl (разб.). Применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии. Уравнения важнейших реакций: Na2S + 2НCl (разб.) = 2NaCl + H2S^ Na2S + 3H2SO4 (конц.) = SO2^ + Sv + 2H2O + 2NaHSO4 (до 50 °C) Na2S + 4HNO3 (конц.) = 2NO^ + Sv + 2H2O + 2NaNO3 (60 °C) Na2S + H2S (насыщ.) = 2NaHS Na2S(т) + 2O2 = Na2SO4 (выше 400 °C) Na2S + 4H2O2 (конц.) = Na2SO4 + 4H2O S2- + M2+ = MnS (телесн.)v; FeS (черн.)v; ZnS (бел.)v S2- + 2Ag+ = Ag2S (черн.)v S2- + M2+ = СdS (желт.)v; PbS, CuS, HgS (черные)v 3S2- + 2Bi3+ = Bi2S3 (кор. – черн.)v 3S2- + 6H2O + 2M3+ = 3H2S^ + 2M(OH)3v (M = Al, Cr) Получение в промышленности – прокаливание минерала мирабилит Na2SO4 10Н2O в присутствии восстановителей: Na2SO4 + 4Н2 = Na2S + 4Н2O (500 °C, кат. Fe2O3) Na2SO4 + 4С (кокс) = Na2S + 4СО (800—1000 °C) Na2SO4 + 4СО = Na2S + 4СO2 (600–700 °C) Сульфид алюминия Al2S3. Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N2, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций: Al2S3 + 6Н2O = 2Al(ОН)3v + 3H2S^ (чистый) Al2S3 + 6НCl (разб.) = 2AlCl3 + 3H2S^ Al2S3 + 24HNO3 (конц.) = Al2(SO4)3 + 24NO2^ + 12H2O (100 °C) 2Al2S3 + 9O2 (воздух) = 2Al2O3 + 6SO2 (700–800 °C) Получение: взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги: 2Al + 3S = AL2S3 (150–200 °C) Сульфид железа (II) FeS. Бескислородная соль. Черно-серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Соединение железа(III) состава Fe2S3 не известно (не получено). Уравнения важнейших реакций: 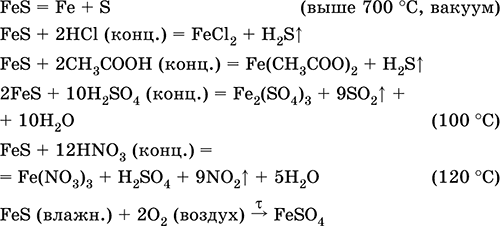 Получение: Fe + S = FeS (600 °C) Fe2O3 + H2 + 2H2S = 9FeS + 3H2O (700-1000 °C) FeCl2 + 2NH4HS (изб.) = FeS v + 2NH4Cl + H2S^ Дисульфид железа FeS2. Бинарное соединение. Имеет ионное строение Fe2+ (—S – S—)2-. Темно-желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами-окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит. Уравнения важнейших реакций: FeS2 = FeS + S (выше 1170 °C, вакуум) 2FeS2 + 14H2SO4 (конц., гор.) = Fe2(SO4)3 + 15SO2^ + 14Н2O FeS2 + 18HNO3 (конц.) = Fe(NO3)3 + 2H2SO4 + 15NO2^ + 7H2O 4FeS2 + 11O2 (воздух) = 8SO2 + 2Fe2O3 (800 °C, обжиг) Гидросульфид аммония NH4HS. Бескислородная кислая соль. Белый, плавится под избыточным давлением. Весьма летучий, термически неустойчивый. На воздухе окисляется. Хорошо растворим в воде, гидролизуется по катиону и аниону (преобладает), создает щелочную среду. Раствор желтеет на воздухе. Разлагается кислотами, в насыщенном растворе присоединяет серу. Щелочами не нейтрализуется, средняя соль (NH4)2S не существует в растворе (условия получения средней соли см. в рубрике «H2S»). Применяется в качестве компонента фотопроявителей, как аналитический реагент (осадитель сульфидов). Уравнения важнейших реакций: NH4HS = NH3 + H2S (выше 20 °C) NH4HS + НCl (разб.) = NH4Cl + H2S^ NH4HS + 3HNO3 (конц.) = Sv + 2NO2^ + NH4NO3 + 2H2O 2NH4HS (насыщ. H2S) + 2CuSO4 = (NH4)2SO4 + H2SO4 + 2CuSv Получение: насыщение концентрированного раствора NH3 сероводородом: NH3 Н2O (конц.) + H2S(г) = NH4HS + Н2O В аналитической химии раствор, содержащий равные количества NH4HS и NH3 Н2O, условно считают раствором (NH4)2S и используют формулу средней соли в записи уравнений реакций, хотя сульфид аммония полностью гидролизуется в воде до NH4HS и NH3 • Н2O. 7.3.3. Диоксид серы. Сульфиты Диоксид серы SO2. Кислотный оксид. Бесцветный газ с резким запахом. Молекула имеет строение незавершенного треугольника [: S(O)2] (sр2-гибридизация), содержит ?,?-связи S=O. Легко сжижается, термически устойчивый. Хорошо растворим в воде (~40 л/1 л Н2O при 20 °C). Образует полигидрат, обладающий свойствами слабой кислоты, продукты диссоциации – ионы HSO3- и SO32-. Ион HSO3- имеет две таутомерные формы – симметричную (некислотную) со строением тетраэдра [S(H)(O)3] (sр3-гибридизация), которая преобладает в смеси, и несимметричную (кислотную) со строением незавершенного тетраэдра [: S(O)2(OH)] (sр3-гибридизация). Ион SO32- также тетраэдрический [: S(O)3]. Реагирует со щелочами, гидратом аммиака. Типичный восстановитель, слабый окислитель. Качественная реакция – обесцвечивание желто-коричневой «йодной воды». Промежуточный продукт в производстве сульфитов и серной кислоты. Применяется для отбеливания шерсти, шелка и соломы, консервирования и хранения фруктов, как дезинфицирующее средство, антиоксидант, хладагент. Ядовит. Соединение состава H2SO3 (сернистая кислота) не известно (не существует). Уравнения важнейших реакций: 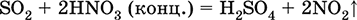 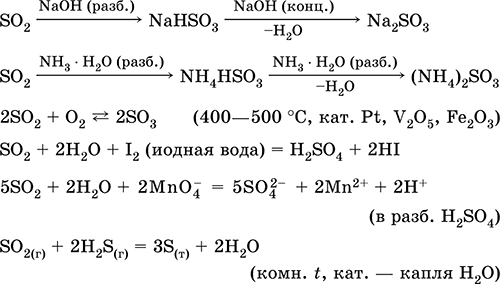 Растворение в воде и кислотные свойства: 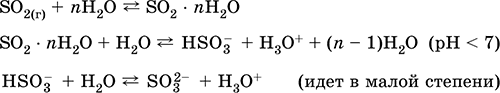 Получение: в промышленности – сжигание серы в воздухе, обогащенном кислородом, и, в меньшей степени, обжиг сульфидных руд (SO2 – попутный газ при обжиге пирита): S + O2 = SO2 (280–360 °C) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (800 °C, обжиг) в лаборатории – вытеснение серной кислотой из сульфитов: BaSO3(т) + H2SO4 (конц.) = BaSO4v + SO2^ + Н2O Сульфит натрия Na2SO3. Оксосоль. Белый. При нагревании на воздухе разлагается без плавления, плавится под избыточным давлением аргона. Во влажном состоянии и в растворе чувствителен к кислороду воздуха. Хорошо растворим в воде, гидролизуется по аниону. Разлагается кислотами. Типичный восстановитель. Качественная реакция на ион SO32- – образование белого осадка сульфита бария, который переводится в раствор сильными кислотами (НCl, HNO3). Применяется как реактив в аналитической химии, компонент фотографических растворов, нейтрализатор хлора при отбеливании тканей. Уравнения важнейших реакций: 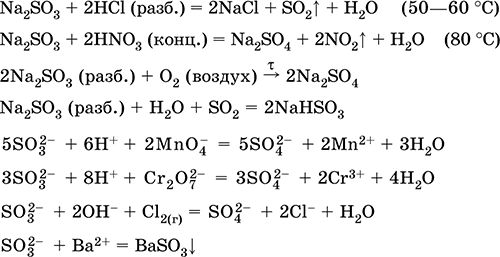 Получение: Na2CO3 (конц.) + SO2 = Na2SO3 + CO2^ 7.3.4. Серная кислота. Сульфаты Серная кислота H2SO4. Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно-тетраэдрическое строение [S(O)2(OH)2] (sр3-гибридизация), содержит ковалентные ?-связи S – ОН и ??-связи S=O. Ион SO42- имеет правильно-тетраэдрическое строение [S(O)4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо-эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет НI), сильный – в концентрированном растворе (за счет SVI). Хорошо растворяет SO3 и реагирует с ним (образуется тяжелая маслообразная жидкость — олеум, содержит H2S2O7). Качественная реакция на ион SO42- – осаждение белого сульфата бария BaSO4 (осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO3). Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций: 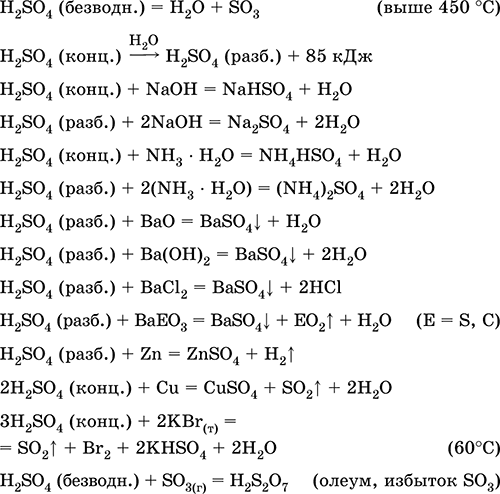 Получение в промышленности: а) синтез SO2 из серы, сульфидных руд, сероводорода и сульфатных руд: S + O2 (воздух) = SO2 (280–360 °C) 4FeS2 + 11O2 (воздух) = 8SO2 + 2Fe2O3 (800 °C, обжиг) 2H2S + 3O2 (изб.) = 2SO2 + 2Н2O (250–300 °C) CaSO4 + С (кокс) = СаО + SO2 + СО (1300–1500 °C) б) конверсия SO2 в SO3 в контактном аппарате: 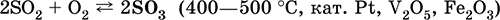 в) синтез концентрированной и безводной серной кислоты: Н2O (разб. H2SO4) + SO3 = H2SO4 (конц., безводн.) (поглощение SO3 чистой водой с получением H2SO4 не проводится из-за сильного разогревания смеси и обратного разложения H2SO4, см. выше); г) синтез олеума – смеси безводной H2SO4, дисерной кислоты H2S2O7 и избыточного SO3. Растворенный SO3 гарантирует безводность олеума (при попадании воды тут же образуется H2SO4), что позволяет безопасно перевозить его в стальных цистернах. Сульфат натрия Na2SO4. Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H2SO4 (конц.), SO3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена. Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара-Богаз-Гол Каспийского моря. Уравнения важнейших реакций: 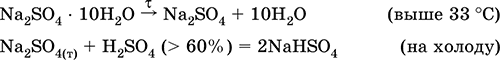 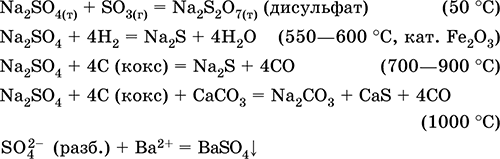 Гидросульфат калия KHSO4. Кислая оксосоль. Белый, гигроскопичный, но кристаллогидратов не образует. При нагревании плавится и разлагается. Хорошо растворим в воде, в растворе анион подвергается диссоциации, среда раствора сильнокислотная. Нейтрализуется щелочами. Применяется как компонент флюсов в металлургии, составная часть минеральных удобрений. Уравнения важнейших реакций: 2KHSO4 = K2SO4 + H2SO4 (до 240 °C) 2KHSO4 = K2S2O7 + Н2O (320–340 °C) KHSO4 (разб.) + КОН (конц.) = K2SO4 + Н2O KHSO4 + КCl = K2SO4 + НCl (450–700 °C) 6KHSO4 + М2O3 = 2KM(SO4)2 + 2K2SO4 + 3H2O (350–500 °C, M = Al, Cr) Получение: обработка сульфата калия концентрированной (более чем 6O%-ной) серной кислотой на холоду: K2SO4 + H2SO4 (конц.) = 2KHSO4 Сульфат кальция CaSO4. Оксосоль. Белый, весьма гигроскопичный, тугоплавкий, при прокаливании разлагается. Природный CaSO4 встречается в виде очень распространенного минерала гипс CaSO4 2Н2O. При 130 °C гипс теряет часть воды и переходит в жжёный (штукатурный) гипс 2CaSO4 • Н2O (техническое название алебастр). Полностью обезвоженный (200 °C) гипс отвечает минералу ангидрит CaSO4. Малорастворим в воде (0,206 г/100 г Н2O при 20 °C), растворимость уменьшается при нагревании. Реагирует с H2SO4 (конц.). Восстанавливается коксом при сплавлении. Определяет большую часть «постоянной» жесткости пресной воды (подробнее см. 9.2). Уравнения важнейших реакций: 100–128 °C 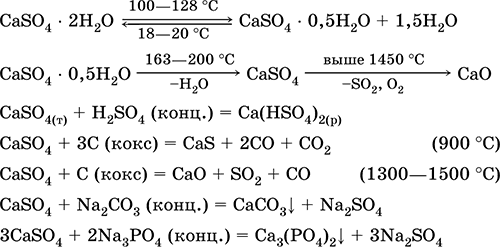 Применяется как сырье в производстве SO2, H2SO4 и (NH4)2SO4, как флюс в металлургии, наполнитель бумаги. Приготовленный из жженого гипса вяжущий строительный раствор «схватывается» быстрее, чем смесь на основе Са(ОН)2. Затвердевание обеспечивается связыванием воды, образованием гипса в виде каменной массы. Используется жженый гипс для изготовления гипсовых слепков, архитектурно-декоративных форм и изделий, перегородочных плит и панелей, каменных полов. Сульфат алюминия-калия KAl(SO4)2. Двойная оксосоль. Белый, гигроскопичный. При сильном нагревании разлагается. Образует кристаллогидрат — алюжокалиевые квасцы. Умеренно растворим в воде, гидролизуется по катиону алюминия. Реагирует со щелочами, гидратом аммиака. Применяется как протрава при крашении тканей, дубитель кож, коагулянт при очистке пресной воды, компонент составов для проклеивания бумаги, наружное кровоостанавливающее средство в медицине и косметологии. Образуется при совместной кристаллизации сульфатов алюминия и калия. Уравнения важнейших реакций: 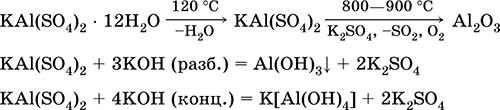 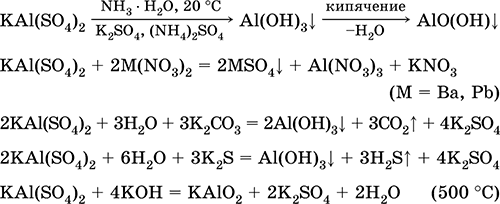 Сульфат хрома(III) – калия KCr(SO4)2. Двойная оксосоль. Красный (гидрат темно-фиолетовый, техническое название хрожокалиевые квасцы). При нагревании разлагается без плавления. Хорошо растворим в воде (серо-синяя окраска раствора отвечает аквакомплексу [Cr(Н2O)6]3+), гидролизуется по катиону хрома(III). Реагирует со щелочами, гидратом аммиака. Слабый окислитель и восстановитель. Вступает в реакции ионного обмена. Качественные реакции на ион Cr3+ – восстановление до Cr2+ или окисление до желтого CrO42-. Применяется как дубитель кож, протрава при крашении тканей, реактив в фотографии. Образуется при совместной кристаллизации сульфатов хрома(III) и калия. Уравнения важнейших реакций: 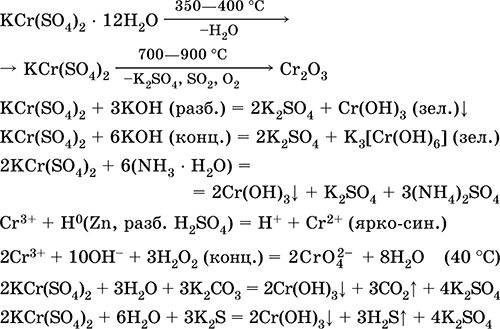 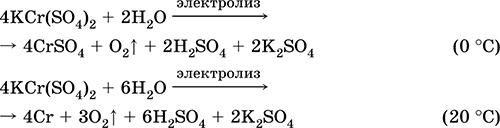 Сульфат марганца (II) MnSO4. Оксосоль. Белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO4 5Н2O – красно-розовый, техническое название марганцевый купорос. Хорошо растворим в воде, светло-розовая (почти бесцветная) окраска раствора отвечает аквакомплексу [Mn(Н2O)6]2+; гидролизуется по катиону. Реагирует со щелочами, гидратом аммиака. Слабый восстановитель, реагирует с типичными (сильными) окислителями. Качественные реакции на ион Mn2+ – конмутация с ионом MnO4 и исчезновение фиолетовой окраски последнего, окисление Mn2+ до MnO4 и появление фиолетовой окраски. Применяется для получения Mn, MnO2 и других соединений марганца, как микроудобрение и аналитический реагент. Уравнения важнейших реакций: 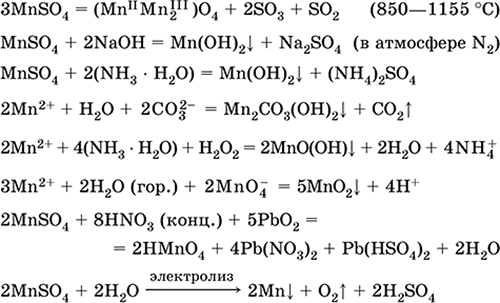 Получение: 2MnO2 + 2H2SO4 (конц.) = 2MnSO4 + O2^ + 2H2O (100 °C) Сульфат железа (II) FeSO4. Оксосоль. Белый (гидрат светло-зеленый, техническое название железный купорос), гигроскопичный. Разлагается при нагревании. Хорошо растворим в воде, в малой степени гидролизуется по катиону. Быстро окисляется в растворе кислородом воздуха (раствор желтеет и мутнеет). Реагирует с кислотами-окислителями, щелочами, гидратом аммиака. Типичный восстановитель. Применяется как компонент минеральных красок, электролитов в гальванотехнике, консервант древесины, фунгицид, лекарственное средство против анемии. В лаборатории чаще берется в виде двойной соли Fe(NH4)2(SO4)2 6Н2O (соль Мора), более устойчивой к действию воздуха. Уравнения важнейших реакций: 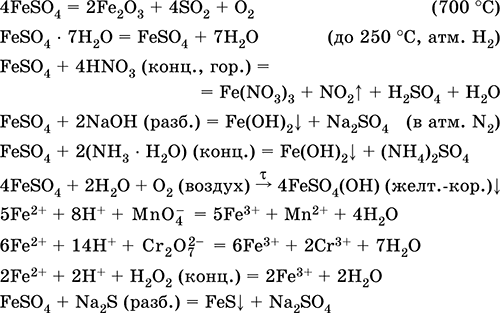 Получение: Fe + H2SO4 (разб.) = FeSO4 + H2^ FeCO3 + H2SO4 (разб.) = FeSO4 + CO2^ + H2O 7.4. Неметаллы VA-группы 7.4.1. Азот. Аммиак Азот – элемент 2-го периода и VA-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0, -III, +III и +V, реже +II, +IV и др.; состояние Nv считается относительно устойчивым. Шкала степеней окисления азота: 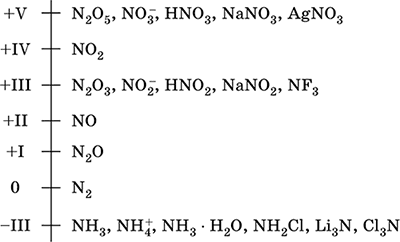 Азот обладает высокой электроотрицательностью (3,07), третий после F и О. Проявляет типичные неметаллические (кислотные) свойства. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, а также катион аммония NH4+ и его соли. В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов. Азот N2. Простое вещество. Состоит из неполярных молекул с очень устойчивой ???-связью N ? N, этим объясняется химическая инертность азота при обычных условиях. Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2). Главная составная часть воздуха: 78,09 % по объему, 75,52 % по массе. Из жидкого воздуха азот выкипает раньше кислорода O2. Малорастворим в воде (15,4 мл/1 л Н2O при 20 °C), растворимость азота меньше, чем у кислорода. При комнатной температуре N2 реагирует только с литием (во влажной атмосфере), образуя нитрид лития Li3N, нитриды других элементов синтезируют при сильном нагревании: N2 + 3Mg = Mg3N2 (800 °C) В электрическом разряде N2 реагирует с фтором и в очень малой степени – с кислородом:  Обратимая реакция получения аммиака протекает при 500 °C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe/F2O3/FeO, в лаборатории Pt): 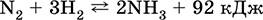 В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450–500 °C, достигая 15 %-ного выхода аммиака. Непрореагировавшие N2 и Н2 возвращают в реактор и тем самым увеличивают степень протекания реакции. Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения. Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2С (кокс) + O2 = 2СО при нагревании. В этих случаях получают азот, содержащий также примеси благородных газов (главным образом аргон). В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании: N-IIIH4NIIIO2(т) = N20 + 2H2O (60–70 °C) NH4Cl(p) + KNO2(p) = N20^ + KCl + 2H2O (100 °C) Применяется для синтеза аммиака, азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ. Аммиак NH3. Бинарное соединение, степень окисления азота равна – III. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3)] (sр3-гибридизация). Наличие у азота в молекуле NH3 донорной пары электронов на sр3-гибридной орбитали обусловливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4+. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л Н2O при 20 °C); доля в насыщенном растворе равна = 34 % по массе и = 99 % по объему, рН = 11,8. Весьма реакционноспособный, склонен к реакциям присоединения. Crорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N-III) и окислительные (за счет НI) свойства. Осушается только оксидом кальция. Качественные реакции – образование белого «дыма» при контакте с газообразным НCl, почернение бумажки, смоченной раствором Hg2(NO3)2. Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит. Уравнения важнейших реакций: 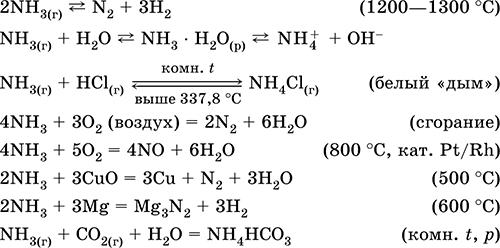 Получение: в лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + СаО): 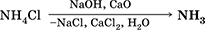 или кипячение водного раствора аммиака с последующим осушением газа. В промышленности аммиак синтезируют из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода. Гидрат аммиака NH3 Н2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и Н2O, связанные слабой водородной связью H3N… НОН. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4- и анион ОН-). Катион аммония имеет правильно-тетраэдрическое строение (sp3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет NIII) в концентрированном растворе. Вступает в реакции ионного обмена и комплексообразования. Качественная реакция – образование белого «дыма» при контакте с газообразным НCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов. В 1М растворе аммиака содержится в основном гидрат NH3 Н2O и лишь 0,4 % ионов NH4+ и ОН- (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате. Уравнения важнейших реакций: NH3 Н2O (конц.) = NH3^ + Н2O (кипячение с NaOH) NH3 Н2O + НCl (разб.) = NH4Cl + Н2O 3(NH3 Н2O) (конц.) + CrCl3 = Cr(OH)3v + 3NH4Cl 8(NH3 Н2O) (конц.) + ЗBr2(р) = N2^ + 6NH4Br + 8Н2O (40–50 °C) 2(NH3 Н2O) (конц.) + 2КMnO4 = N2^ + 2MnO2v + 4Н2O + 2КОН 4(NH3 Н2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O 4(NH3 Н2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4Н2O 6(NH3 Н2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6Н2O Разбавленный раствор аммиака (3—10 %-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5—25 %-ный) – аммиачной водой (выпускается промышленностью). 7.4.2. Оксиды азота. Азотная кислота Монооксид азота NO. Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную ??-связь ( N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты. Уравнения важнейших реакций: 2NO + O2 (изб.) = 2NO2 (20 °C) 2NO + С (графит) = N2 + СO2 (400–500 °C) lONO + 4Р (красн.) = 5N2 + 2Р2O5 (150–200 °C) 2NO + 4Cu = N2 + 2Cu2O (500–600 °C) Реакции смеси NO и NO2: NO + NO2 + Н2O = 2HNO2(p) NO + NO2 + 2KOH (разб.) = 2KNO2 + H2O NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (450–500 °C) Получение: в промышленности – окисление аммиака (см.) кислородом на катализаторе, в лаборатории – взаимодействие разбавленной азотной кислоты с восстановителями: 8HNO3 (хол.) + 6Hg = 3Hg2(NO3)2 + 2NO^ + 4Н2O или восстановление нитритов: 2NaNO2 + 2H2SO4 (разб.) + 2NaI = 2NO^ + I2v + 2H2O + 2Na2SO4 Диоксид азота NO2. Кислотный оксид, условно отвечает двум кислотам – HNO2 и HNO3 (кислота для NIV не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2O4 (тетраоксид диазота). Молекула NO2 – радикал со строением незавершенного треугольника [-N(O)2] (sр2-гибридизация) с ковалентными ?, ?-связями N=O. Молекула N2O4 содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7—135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций: 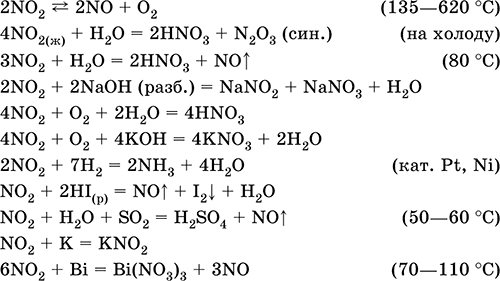 Получение: в промышленности – окисление NO (см.) кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями: 6HNO3 (конц., гор.) + S = H2SO4 + 6NO2^ + 2Н2O 5HNO3 (конц., гор.) + Р (красн.) = Н3РO4 + 5NO2^ + Н2O 2HNO3 (конц., гор.) + SO2 = H2SO4 + 2NO2^ Оксид диазота N2O. Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния: 2N2O + С = СO2 + 2N2 (450 °C) N2O + Mg = N2 + MgO (500 °C) Получают термическим разложением нитрата аммония: NH4NO3 = N2O + 2Н2O (195–245 °C) Применяется в медицине как анестезирующее средство. Триоксид диазота N2O3. При низких температурах – синяя жидкость, ON=NO2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2, при нагревании реагирует иначе: 3N2O3 + Н2O = 2HNO3 + 4NO^ Со щелочами дает соли HNO2, например NaNO2. Получают взаимодействием NO с O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO + NO2 = N2O3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы. Пентаоксид диазота N2O5. Бесцветное твердое вещество, O2N – О—NO2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид: N2O5 + Н2O = 2HNO3 N2O5 + 2NaOH = 2NaNO3 + H2O Получают дегидратацией дымящей азотной кислоты: 2HNO3 + Р2O5 = N2O5 + 2НРO3 или окислением NO2 озоном при -78 °C: 2NO2 + O3 = N2O5 + O2 Азотная кислота HNO3. Оксокислота. Бесцветная жидкость. Молекула имеет искаженно-треугольное строение [N(O)2(OH)] (sp2– гибридизация), содержит ковалентные ??-связи N=O и о-связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно-бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO3 Н2O (точнее, H3NO4 – ортоазотная кислота). Сильная кислота в растворе, ион NO3- имеет строение правильного треугольника (sр2-гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет Nv). Образует смесь продуктов восстановления азота – от NIVO2 до N-IIIН4+, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO2, для разбавленной – NO, для очень разбавленной – NH4+). Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO3 (конц.) и НCl (конц.) – «царская водка» – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO3 в ее реакциях с органическими веществами является ион NO2+ (нитроил). В отличие от самой кислоты HNO3 ее соли — нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по-разному, в зависимости от положения металла в ряду напряжений:  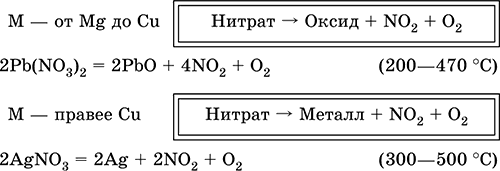 Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов. Уравнения важнейших реакций: 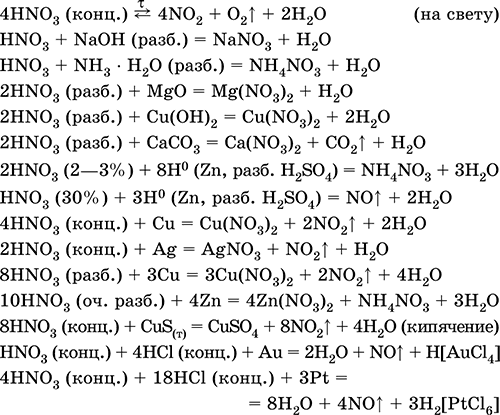 Получение: промышленный синтез состоит из следующих этапов: N2 + Н2 > NH3 > NO > NO2 > HNO3 > HNO3, а именно: производство аммиака (см.), каталитическое окисление аммиака (см.) до NO, перевод NO (см.) в NO2, поглощение смеси NO2 и O2 водой (см.). 7.4.3. Нитриты. Нитраты Нитрит калия KNO2. Оксосоль. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуется бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2- – обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I-. Применяется в производстве красителей, как аналитический реагент на аминокислоты и иодиды, компонент фотографических реактивов. Уравнения важнейших реакций: 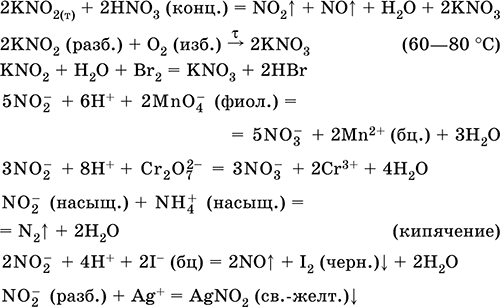 Получение в промышленности – восстановлением калийной селитры в процессах: KNO3 + Pb = KNO2 + PbO (350–400 °C) KNO3 (конц.) + Pb (губка) + Н2O = KNO2 + Pb(OH)2v 2KNO3 + СаО + SO2 = 2KNO2 + CaSO4 (300 °C) Нитрат калия KNO3. Оксосоль. Техническое название калийная, или индийская, селитра. Белый, плавится без разложения, при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо-эффектом, Q = -36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3). Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений. Уравнения важнейших реакций: 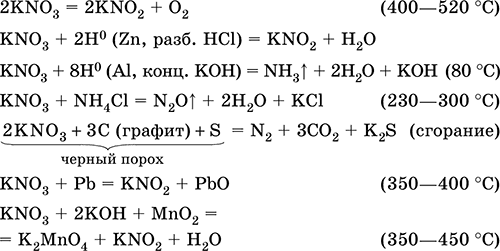 Получение: в промышленности 4KOH (гор.) + 4NO2 + O2 = 4KNO3 + 2Н2O и в лаборатории: КCl + AgNO3 = KNO3 + AgClv 7.4.4. Фосфор Фосфор – элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора: 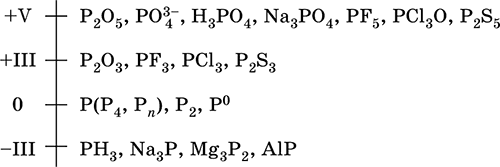 Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде. В природе – тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент. Недостаток фосфора в почве восполняется введением фосфорных удобрений – главным образом суперфосфатов. Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные – это белый фосфор Р4 и красный фосфор Рn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.). Красный фосфор состоит из полимерных молекул Рn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °C возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит. Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °C, tкип 287,3 °C, ? 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства. Восстанавливает благородные металлы из растворов их солей. Применяется в производстве Н3РO4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит. Уравнения важнейших реакций:  Получение в промышленности – восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция): Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C) Пар фосфора охлаждают и получают твердый белый фосфор. Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Рn) может быть различной. Фосфин РН3. Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит. Уравнения важнейших реакций: 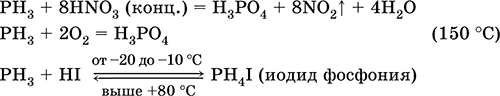 Получение в лаборатории: Са3Р2 + 6НCl (разб.) = ЗСаCl2 + 2РН3^ Оксид фосфора (V) Р2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р – О—Р). При очень высоких температурах мономеризуется до Р2O5. Существует также стеклообразный полимер (Р2O5)n. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот. Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит. Уравнения важнейших реакций: 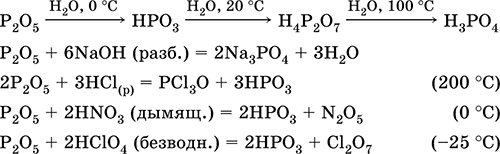 Получение: сжигание фосфора (см.) в избытке сухого воздуха. Ортофосфорная кислота Н3РO4. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия Р2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизация), содержит ковалентные ?-связи Р – ОН и ?, ?-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н2O). Слабая кислота в растворе, нейтрализуется щелочами, не полностью – гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена. Качественная реакция – выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали. Уравнения важнейших реакций:  Получение в промышленности: кипячение фосфоритной руды в серной кислоте: Са3(РO4)2 + 3H2SO4 (конц.) = 2Н3РO4 + 3CaSO4v Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием. Вступает в реакции ионного обмена. Качественная реакция на ион РO43- – образование желтого осадка ортофосфата серебра (I). Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций: Na3PO4 12Н2O = Na3PO4 + 12Н2O (200 °C, вакуум) 2РО43- (конц.) + 8Н2O + 2Al = 2[Al(ОН)4]- + 2НРО42- + ЗН2^ 2РО43- (конц.) + 4Н2O + Zn = [Zn(OH)4]2- + 2HPO42- + Н2^ 2РО43- (разб.) + ЗСа2+ = Са3(РO4)2v РО43- (разб.) + 3Ag+ = Ag3PO4v (желт.)v Получение: полная нейтрализация Н3РO4 (см.) гидроксидом натрия или по реакции: 2Н3РO4 + 3Na2CO3 = 2Na3PO4 + 3CO2^ + 3H2O Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3РO4 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион НРО42- – образование желтого осадка ортофосфата серебра (I). Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей. Уравнения важнейших реакций: 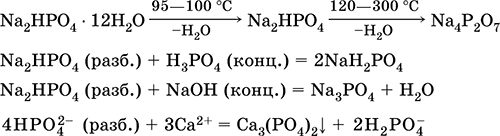 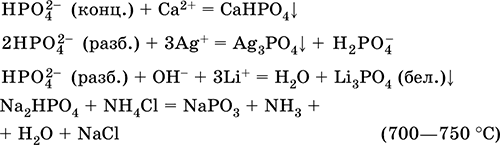 Получение: неполная нейтрализация Н3РO4 гидроксидом натрия в разбавленном растворе: 2NaOH + Н3РO4 = Na2HPO4 + 2Н2O Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2РO4 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион Н2РO4 – образование желтого осадка ортофосфата серебра(I). Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды. Уравнения важнейших реакций: 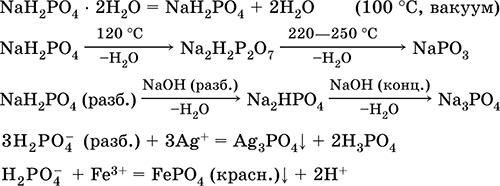 Получение: неполная нейтрализация Н3РO4 едким натром: Н3РO4 (конц.) + NaOH (разб.) = NaH2PO4 + Н2O Ортофосфат кальция Са3(РO4)2. Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.). Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок – как компонент зубных паст и стабилизатор полимеров. Уравнения важнейших реакций: Са3(РO4)2 + 2H2SO4 (60 %) = Са(Н2РO4)2v + 2CaSO4v (до 50 °C) Са3(РO4)2 + 4Н3РO4 (40 %) = ЗСа(Н2РO4)2v (примесь СаНРO4) Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C) Смесь Са(Н2РO4)2 и CaSO4 называется простым суперфосфатом, Са(Н2РO4)2 с примесью СаНРO4 — двойным суперфосфатом, они легко усваиваются растениями при подкормке. Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4. Хлорид фосфора (V) РCl5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sр3d-гибридизация). В твердом состоянии димер Р2Cl10 с ионным строением РCl4+[РCl6]-. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит. Уравнения важнейших реакций: 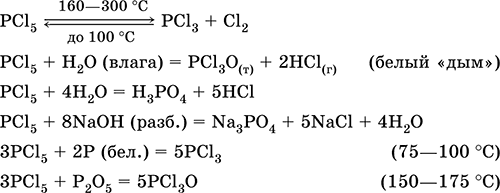 Получение: хлорирование фосфора. 7.5. Неметаллы IVA-группы 7.5.1. Углерод в свободном виде Углерод – элемент 2-го периода и IVA-группы Периодической системы, порядковый номер 6. Химия углерода – это в основном химия органических соединений; неорганических производных углерода не так много. Электронная формула атома [3He]2s22p2, характерные степени окисления 0, -IV, +II и +IV, состояние CIV считается устойчивым. Шкала степеней окисления углерода: 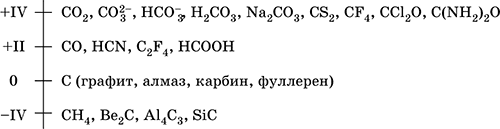 Углерод имеет среднюю для неметаллов электроотрицательность (2,50), проявляет неметаллические (кислотные) свойства. Неорганические углеродсодержащие вещества – оксиды, угольная кислота и ее соли, бинарные соединения; органические вещества – практически неограниченное число соединений с водородом (углеводороды) и их производных, содержащих различные по длине цепи и циклы атомов углерода. В природе – одиннадцатый по химической распространенности элемент (четвертый среди неметаллов). Встречается в самородном состоянии (алмаз, графит) и в виде соединений. Жизненно важный элемент для всех организмов. Аллотропные формы углерода С. В свободном виде углерод существует в виде четырех аллотропных модификаций: графит, алмаз, карбин и фуллерен. Г р а ф и т – устойчивая аллотропная форма существования элемента. Серо-черный, с металлическим блеском, жирный на ощупь, мягкий, обладает электропроводимостью. Кристаллическая решетка состоит из слоев правильных шестиугольных колец, конденсированных по всем сторонам за счет оя-связей (вр2-гибридизация). Реагирует с водяным паром, кислотами-окислителями. Типичный восстановитель при сплавлении, реагирует с кислородом, оксидами металлов и солями. Восстанавливается водородом и металлами. Для графита характерно образование множества карбидов – солеобразных (СаС2, Al4С3), ковалентных (карборунд SiC), металлоподобных (имеющих нестехиометрический состав, например цементит Fe3C). Солеобразные карбиды полностью гидролизуются в воде. Применяется как конструкционный материал, основа угольных электродов, замедлитель нейтронов в ядерных реакторах, кокс – восстановитель в металлургии и химической технологии, сажа – наполнитель резины. Алмаз содержит в узлах кристаллической решетки атомы С с тетраэдрическим окружением (sр3-гибридизация, р 3,52 г/см3). Благородный камень, имеет наибольшую твердость среди природных веществ. Химическая активность ниже, чем у графита. Выше 1200 °C переходит в графит. В чистом состоянии алмазы – прозрачные бесцветные кристаллы с сильным преломляющим эффектом. После обработки природных алмазов (огранка, шлифовка) получают ювелирные драгоценные камни — бриллианты. Менее чистые алмазы обычно окрашенные и мутные, например серо-голубой и черный (карбонадо). В промышленности из графита при 2000 °C под очень высоким давлением получают мелкие кристаллы искусственных алмазов. Применяются они для изготовления режущих инструментов и точных измерительных приборов. Карбин состоит из линейных макромолекул (С2)n со строением —C?C– или =C=C= (sр-гибридизация, ? 3,27 г/см3). Химически менее активен, чем графит. При 2300 °C переходит в графит. Прозрачен и бесцветен, полупроводник. Широкого применения не имеет, очень редко встречается в природе. Фуллерен состоит из молекул C60 или C70 (полые сферы; sр2-гибридизация, ? 1,7 г/см3, температура плавления 500–600 °C для С60), термически устойчив до 900– 1000 °C. Темноокрашенный порошок, растворим в гексане (темно-красный раствор для С60 темно-оранжевый для С70), полупроводник. Химические свойства изучены мало. Получают фуллерен, испаряя графит в атмосфере гелия при пониженном давлении. Обнаружен в природе. Возможное использование в будущем – основа сверхпроводящих материалов. Ниже рассматриваются свойства графита как самой распространенной и химически активной формы углерода. Уравнения важнейших реакций: 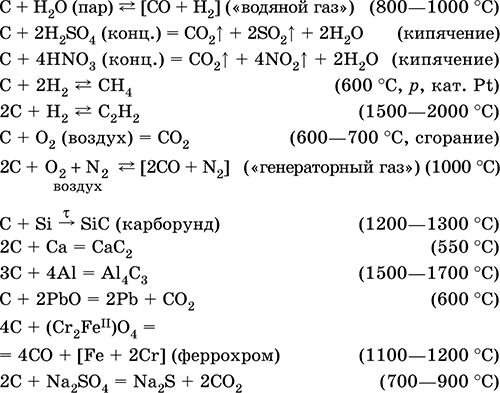 Получение: искусственные формы графита — кокс и сажа образуются при пиролизе каменного угля и углеводородов. 7.5.2. Оксиды углерода Монооксид углерода СО. Несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Молекула слабополярна, содержит ковалентную тройную ???-связь [:C?O;], изоэлектронна молекуле N2. Термически устойчив. Малорастворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с кислородом и пероксидом натрия. С переходными металлами образует комплексные соединения без внешней сферы (карбонилы). Количественно реагирует с I2O5. Качественная реакция – помутнение раствора хлорида палладия(II). Применяется как реагент в органическом синтезе, промышленно важный восстановитель металлов из их руд. Чрезвычайно ядовит, загрязняет атмосферу городов (продукт неполного сгорания моторного топлива). По тому же механизму, что и кислород, СО присоединяется к атому железа в гемоглобине крови, причем связывается более прочно и тем самым блокирует перенос кислорода в организме, вызывая сильное отравление и остановку дыхания; отсюда тривиальное название СО — угарный газ. Уравнения важнейших реакций: 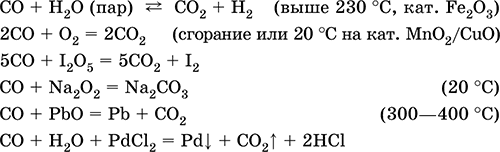 Получение в промышленности: сжигание кокса (см.) при недостатке кислорода, восстановление раскаленным коксом углекислого газа и водяного пара:  Диоксид углерода СO2. Кислотный оксид. Техническое название — углекислый газ. Бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молекула неполярна, имеет линейное строение [С(O)2] (sр-гибридизация), содержит ковалентные ??-связи С=O. Термически устойчив до температуры красного каления. При сжатии (давление = 50 атм) и охлаждении легко переходит в жидкое и твердое («сухой лед») состояния. Твердый СO2 возгоняется уже при низких температурах. Мало растворим в воде (O,88 л/1 л Н2O при 20 °C); образует моногидрат, который медленно изомеризуется (на 0,4 %) в угольную кислоту. Реагирует со щелочами. Восстанавливается магнием и кальцием. Из воздуха удаляется при контакте с пероксидом натрия (одновременно регенерируется кислород). Простейшая качественная реакция – угасание горящей древесной лучинки в атмосфере СO2. Применяется в многотоннажных производствах соды, сахара и карбамида, в пищевой промышленности для газирования безалкогольных напитков и как хладагент. Содержится в воздухе (0,03 % по объему), воде минеральных источников. Не поддерживает горение и дыхание. Ассимилируется зелеными растениями при фотосинтезе (с помощью хлорофилла и под воздействием солнечных лучей). Ядовит при содержании в воздухе свыше 15 % по объему. Уравнения важнейших реакций:  Получение в промышленности – при полном сгорании кокса (см.) или при обжиге известняка: СаСO3 = СаО + СO2 (900—1200 °C) в лаборатории – при обработке карбонатов (например, кусочков мрамора СаСO3) сильными кислотами: СаСO3(т) + H2SO4 = CaSO4v + Н2O + CO2^ 7.5.3. Карбонаты Карбонат натрия Na2CO3. Оксосоль. Техническое название кальцинированная сода. Белый, при нагревании плавится и разлагается. Чувствителен к влаге и углекислому газу в воздухе. Образует декагидрат (кристаллическая сода). Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Восстанавливается коксом. Вступает в реакции ионного обмена. Качественная реакция на ион СО32- – образование белого осадка карбоната бария, разлагаемого сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется для синтеза соединений натрия, устранения «постоянной» жесткости пресной воды, в производстве стекла, мыла и других моющих средств, целлюлозы, минеральных красок, эмалей. В природе содержится в грунтовых рассолах, рапе соляных озер. Уравнения важнейших реакций: 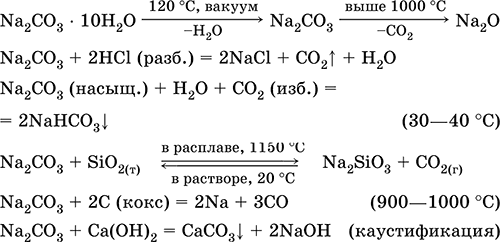 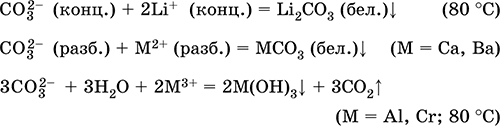 Получение в промышленности (способ Сольве, 1861–1863): а) через насыщенный раствор NaCl пропускают смесь NH3 и СO2: NaCl + NH3 + Н2O + СO2 = NH4Cl + NaHCO3v (в этих условиях питьевая сода малорастворима); б) осадок NaHCO3 подвергают обезвоживанию (кальцинированию): 2NaHCO3 = Na2CO3 + Н2O + СO2 Карбонат калия К2СO3. Оксосоль. Техническое название поташ. Белый, гигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Чувствителен к влаге и углекислому газу в воздухе. Очень хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Вступает в реакции ионного обмена. Применяется в производстве оптического стекла, жидкого мыла, минеральных красок, многих соединений калия, как дегидратирующий агент. Уравнения важнейших реакций: 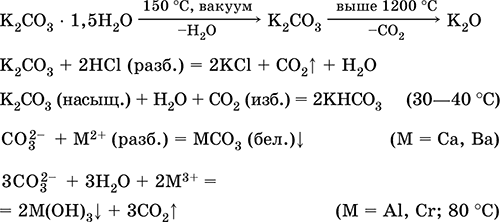 Получение в промышленности: а) нагревание сульфата калия [природное сырье – минералы каинит KMg(SO4)Cl ЗН2O и шёнит K2Mg(SO4)2 • 6Н2O] с гашёной известью Са(ОН)2 в атмосфере СО (давление = 15 атм): K2SO4 + Са(ОН)2 + 2СО = 2K(HCOO) + CaSO4 б) прокаливание формиата калия К(НСОО) на воздухе: 2K(HCOO) + O2 = К2СO3 + Н2O + СO2 Гидрокарбонат натрия NaHCO3. Кислая оксосоль. Техническое название питьевая сода. Белый рыхлый порошок. При слабом нагревании разлагается без плавления, во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворим в воде, гидролизуется по аниону в небольшой степени. Разлагается кислотами, нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион НСОд – образование белого осадка карбоната бария при действии баритовой воды и разложение осадка сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется в пищевой промышленности, как лекарственное средство. Уравнения важнейших реакций: 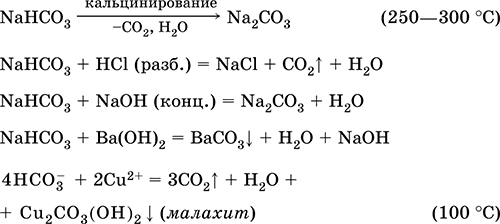 Получение: насыщение раствора Na2CO3 (см.) углекислым газом. Карбонат кальция СаСO3. Оксосоль. Распространенное природное вещество, главная составная часть осадочной горной породы – известняка (его разновидности – мел, мрамор, известковый туф, мергель), чистый СаСO3 в природе – это минерал кальцит. Белый, при прокаливании разлагается, плавится под избыточным давлением СO2. Нерастворим в воде (= 0,0007 г/100 г Н2O). Реагирует с кислотами, солями аммония в горячем растворе, коксом. Переводится в раствор действием избытка углекислого газа с образованием гидрокарбоната Са(НСO3)2 (существует только в растворе), который определяет «временную» жесткость пресной воды (вместе с солями магния и железа). Устранение жесткости (умягчение воды) проводится кипячением или нейтрализацией гашёной известью. Применяется для производства СаО, СO2, цемента, стекла и минеральных удобрений [в том числе известковой селитры Ca(NO3)2 4Н2O], как наполнитель бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осажденного порошка – для изготовления школьных мелков, зубных порошков и паст, смесей для побелки помещений. Уравнения важнейших реакций: 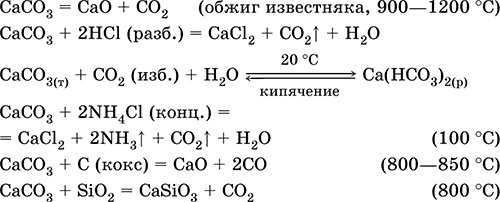 7.5.4. Кремний Кремний – элемент 3-го периода и IVA-группы Периодической системы, порядковый номер 14. Электронная формула атома [10Ne]3s23p2. Характерная степень окисления в соединениях +IV. Шкала степеней окисления кремния: 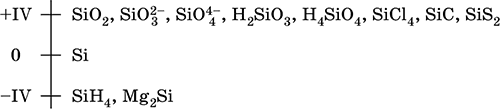 Электроотрицательность кремния невысока для неметаллов (2,25). Проявляет неметаллические (кислотные) свойства; образует оксиды, кремниевые кислоты, очень большое число солей – силикатов в виде цепей, лент и трехмерных сеток тетраэдров [SiO4], бинарные соединения. В настоящее время широко развивается химия органических соединений кремния со связями Si – С и кремнийорганических полимеров – силиконов и силиконовых каучуков со связями Si – Si, Si – О и Si – С. Важнейший элемент неживой природы, второй по химической распространенности. Встречается только в связанном виде. Жизненно важный элемент для многих организмов. Кремний Si. Простое вещество. Крупнокристаллический – темно-серый, с металлическим блеском, весьма твердый, очень хрупкий, непрозрачный, тугоплавкий, распространенный полупроводник. Кристаллическая решетка – атомная, связи Si – Si очень прочные. Аморфный – белый или желто-коричневый (с примесями, в основном Fe), химически более активен. Устойчив на воздухе (покрыт прочной оксидной пленкой), не реагирует с водой. Реагирует с HF (конц.), щелочами. Окисляется кислородом, хлором. Восстанавливается магнием. Спекается с графитом. Промышленно важным является сплав с железом – ферросилиций (12–90 % Si). Применяется как легирующая добавка в стали и сплавы цветных металлов, компонент полупроводниковых материалов для микроэлектроники, основа силиконов. Уравнения важнейших реакций: 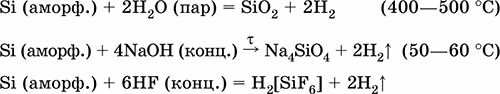  Получение в промышленности: восстановление SiCl4 или SiO2 при прокаливании: SiCl4 + 2Zn = Si + 2ZnCl2 SiO2 + 2Mg = Si + 2MgO (последняя реакция может быть осуществлена и в лаборатории, после обработки соляной кислотой остается аморфный кремний). Диоксид кремния SiO2. Кислотный оксид. Белый порошок (кварцевый песок) и прозрачные кристаллы, природный продукт окрашен примесями (кремнезём) – в виде обычного песка и камня (кремень). Кристаллическая решетка атомная, каждый атом кремния окружен четырьмя атомами кислорода [Si(O)4], а каждый атом кислорода – двумя атомами кремния [O(Si)2]. Имеет несколько кристаллических модификаций (все минералы), важнейшие — кварц, тридимит и кристобалит, редко встречающиеся и искусственно полученные — китит, коэсит, стишовит, меланофлогит, волокнистый кремнезём. Тугоплавкий, при медленном охлаждении расплава образуется аморфная форма – кварцевое стекло (в природе минерал лешательеит). Наиболее химически активна аморфная форма. Практически не реагирует с водой (из раствора осаждается гидрат SiO2 nН2O), распространенными кислотами. Кварцевое стекло разъедается в HF (конц.). Реагирует со щелочами в растворе (образует ортосиликаты) и при сплавлении (продукты — метасиликаты). Легко хлорируется в присутствии кокса. Восстанавливается коксом, магнием, железом (в доменном процессе). Применяется как промышленное сырье в производстве кремния, обычного, термо– и химически стойкого стекла, фарфора, керамики, абразивов и адсорбентов, наполнитель резины, смазок, клеев и красок, компонент строительных связующих растворов, в виде монокристаллов кварца – основа генераторов ультразвука и точного хода кварцевых часов. Разновидности кварца (горный хрусталь, розовый кварц, аметист, дымчатый кварц, халцедон, оникс и др.) – драгоценные, полудрагоценные или поделочные камни. Уравнения важнейших реакций:  Полигидрат диоксида кремния SiO2 nH2O. Кремниевые кислоты с переменным содержанием SiO2 и Н2O. Белый, аморфный (стекловидный) полимер с цепочечным, ленточным, листовым, сетчатым и каркасным строением. При нагревании постепенно разлагается. Очень мало растворим в воде. Над осадком в растворе существует мономерная слабая ортокремниевая кислота H4SiO4 (тетраэдрическое строение, sр3-гибридизация), растворимость 0,00673 г/100 г Н2O при 20 °C. При стоянии раствора идет поликонденсация и медленно образуются вначале кремниевые кислоты H6Si2O7, H2Si2O5, H10Si2O9, затем гидрозоль [H2SiO3]n (золь метакремниевой кислоты) и, наконец, гидрогель SiO2 • nН2O (n < 2). При высушивании гидрогель переходит в силикагель SiO2 • nН2O (n < 1). Скорость гелеобразования максимальна в слабокислотной среде. Переводится в раствор действием концентрированных щелочей. По остальным химическим свойствам подобен SiO2. В природе – минералы опал и халцедон (агат, яшма). Мономерная метакремниевая кислота H2SiO3 не получена. Уравнения важнейших реакций: 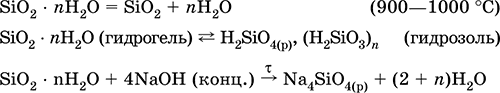 Получение: вытеснение сильной кислотой из раствора силиката, например: K2SiO3 + 2НCl + (n – 1) Н2O = 2КCl + SiO2 nН2Ov Метасиликат натрия Na2SiO3. Оксосоль. Белый, при нагревании плавится без разложения. Растворяется в холодной воде (сильный гидролиз по аниону). Концентрированный раствор – коллоидный («жидкое стекло», содержит гидрозоль SiO2 nН2O). Разлагается в горячей воде, реагирует с кислотами, щелочами, углекислым газом. Применяется как компонент шихты в производстве стекла, специальных цементов и бетонов, входит в состав силикатных красок и клея, холодных глазурей, алюмосиликатных катализаторов, при изготовлении бумаги и картона, силикагеля, синтетических цеолитов. Уравнения важнейших реакций: 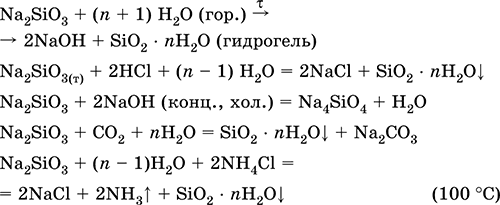 Получение: сплавление соды с песком Na2SiO3 + SiO2 = СO2 + Na2SiO3 (1150 °C) Силикаты. Кремний в степени окисления +IV находится, помимо SiO2, в весьма многочисленных и часто очень сложных по составу и строению силикат-ионах (так, кроме жетасиликат-иона SiO32- и ортосиликат-иона SiO44- известны ионы Si2O76-, Si3O96-, Si2O104- и др.). Для простоты записи все силикаты изображают как содержащие ион SiO32-. Насыщенный раствор силикатов натрия и калия (вязкое «жидкое стекло») используется как силикатный клей. Силикаты натрия и кальция входят в состав стекла; его получают сплавлением кварца SiO2, известняка СаСO3 и соды Na2CO3: 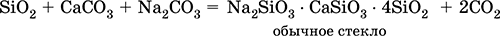 Часто состав стекла выражают через оксиды, например, обычное стекло Na2O СаО • 6SiO2. Среди силикатных минералов отметим глины (алюмосиликаты), очень чистая глина — каолин Al2O3 2SiO2 • 2Н2O используется для изготовления фарфора. Силикаты и алюмосиликаты применяют в промышленности при производстве керамики, цемента, бетона и других строительных материалов. Тетрахлорид кремния SiCl4. Бинарное соединение. Бесцветная жидкость, обладает широким интервалом жидкого состояния. Молекула имеет тетраэдрическое строение (sр3-гибридизация). Термически устойчив. «Дымит» во влажном воздухе. Полностью гидролизуется водой. Разлагается щелочами. Восстанавливается водородом, натрием, цинком. Хлорирует оксид алюминия. Применяется в производстве особо чистого кремния для полупроводниковой техники. Уравнения важнейших реакций: 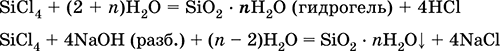 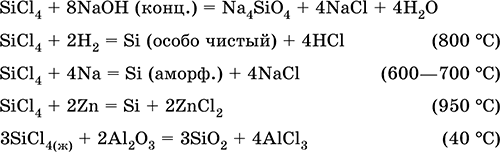 Получение в промышленности – хлорирование кремния или кварцевого песка SiO2. Примеры заданий части А1. Хлор можно собрать 1) в пробирку отверстием вниз 2) в пробирку отверстием вверх 3) над раствором хлорида кальция 4) над водой 2. Пропускают хлор через горячий раствор едкого кали и получают набор продуктов 1) КCl, O2 2) КCl, КClO 3) КCl, Н2 4) КClO3, КCl 3. Возможно протекание реакции в растворе между веществами 1) КBr + I2 >… 2) КBr + Cl2 >… 3) КCl + I2 >… 4) КCl + Br2 >… 4. Окислительная способность в ряду O2 – O3 – О0 1) возрастает 2) убывает 3) не изменяется 4) не знаю 5. При действии концентрированным раствором щелочи на серу образуется набор солей 1) сульфат, сульфид 2) сульфат, сульфит 3) сероводород, серная кислота 4) сульфит, сульфид 6. Концентрированная серная кислота реагирует (по отдельности) с веществами набора 1) KHSO4, K2SO4 2) Fe, Cu(NO3)2 3) Ag, SO2 4) КНСO3, С (графит) 7. Азот образуется при прокаливании солей 1) NH4NO2 2) NH4HCO3 3) NH4NO3 4) (NH4)2Cr2O7 8. В уравнении реакции NH3 + O2 > NO +… коэффициент у формулы окислителя равен 1) 6 2) 5 3) 4 4) 3 9. Нельзя проводить осушку газа NH3 с помощью 1) СаО (тв.) 2) NaOH (тв.) 3) H2SO4 (конц.) 4) Р2O5 (тв.) 10. Две соли разных кислот образуются при взаимодействии между щелочью и 1) диоксидом углерода 2) триоксидом серы 3) оксидом хлора (VII) 4) оксидом азота (IV) 11. Один газ образуется при прокаливании 1) Cu(NO3)2 2) Pb(NO3)2 3) AgNO3 4) KNO3 12. Ортофосфорную кислоту в промышленности получают по реакции 1) Са3(РO4)2 + H2SO4 (конц.) >… 2) К3РO4 + H2SO4 (разб.) >… 3) Р2O5 + Н2O >… 4) Na3PO4 + СаCl2 >… 13. Углекислый газ, растворенный в воде, реагирует (по отдельности) с веществами набора 1) К2СO3, К3РO4 2) KNO2, NH4Cl 3) K2SiO3, К2СO3 4) K2SO4, КОН 14. Реагенты для получения чистого гидрокарбоната калия – это набор 1) KNO3, Н2O, СO2 2) K2SO4, Ва(НСO3)2 3) К2СO3, Н2O 4) КОН, СаСO3 15. Цинк из концентрированного раствора карбоната калия вытесняет 1) водород 2) угарный газ 3) метан 4) углекислый газ 16. Влажную смесь газов SO2 + O2 + NH3 + С2Н2 пропустили через склянку с H2SO4 (конц.), затем – через склянку с гранулами NaOH. При этом на выходе собрали набор газов 1) NH3, С2Н2 2) SO2, O2 3) SO2, NH3 4) O2, С2Н2 17. Для обнаружения хлорид-иона подходит реактив 1) раствор крахмала 2) раствора нитрата серебра(I) 3) разбавленная серная кислота 4) концентрированный раствор щелочи 18. Для распознавания Na2CO3 и Na2SiO3 можно использовать раствор 1) азотной кислоты 2) индикатора 3) хлорида бария 4) гидроксида натрия 19—22. Бесцветный раствор соли 19. иодид алюминия 20. гидросульфат калия 21. хлорид бария 22. фторид натрия окрасится метилоранжем в цвет 1) оранжевый 2) желтый 3) синий 4) розовый |
|
||

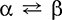 при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S8 (неплоские циклы типа «корона»), аморфная сера состоит из цепей Sn. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S8, переплетение цепей Sn). В паре – молекулы S8, S6, S4, S2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S8 (неплоские циклы типа «корона»), аморфная сера состоит из цепей Sn. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S8, переплетение цепей Sn). В паре – молекулы S8, S6, S4, S2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).